
科目: 来源: 题型:
【题目】在1L的密闭容器中,发生3A(g)+B(g)2C(g)的反应,若最初加入A和B都是4mol,1min内,测得υ(A)=1.2mol·L﹣1·min﹣1,则此时容器中B的物质的量是
A. 1.6mol B. 2.8mol C. 3.2mol D. 3.6mol
查看答案和解析>>
科目: 来源: 题型:
【题目】某兴趣小组制备氢氧化亚铁沉淀。
实验1 |
| 实验现象 |
液面上方产生白色絮状沉淀,迅速变为灰绿色,振荡,试管壁上有红褐色沉淀生成。 |
(1)实验1中产生白色沉淀的离子方程式是________________。
(2)为了探究沉淀变灰绿色的原因,该小组同学展开如下探究:
① 甲同学推测灰绿色物质为Fe(OH)2和Fe(OH)3混合物。查阅资料后根据调色原理认为白色和红褐色的调和色不可能是灰绿色,并设计实验证实灰绿色物质中不含有 Fe(OH)3,方案是__________。
② 乙同学查阅文献:Fe(OH)2在大量SO42存在的情况下形成Fe6(SO4)2(OH)4O3(一种氧基碱式复盐)。并设计对比实验证实该假设:向试管中加入_____________,再往试管中加入____________,振荡,现象与实验1相同,结论是该假设不成立。
③ 乙同学继续查阅文献:Fe(OH)2沉淀具有较强的吸附性能,灰绿色可能是由Fe(OH)2表面吸附Fe2+引起。推测所用的硫酸亚铁溶液的浓度应越小越好;氢氧化钠溶液浓度应越大越好。设计了如下实验方案:
试管中10 mL NaOH溶液 | 滴加 FeSO4溶液 | 实验现象 | |
实验2 | 6 mol/L NaOH溶液 | 0.2mol/L FeSO4溶液 | 产生悬浮于液面的白色沉淀(带有少量灰绿色) ,沉淀下沉后,大部分灰绿色变为白色沉淀 |
实验3 | 6 mol/L NaOH溶液 | 0.1mol/L FeSO4溶液 | 产生悬浮于液面的白色沉淀(带有极少量灰绿色) ,沉淀下沉后,底部都为白色沉淀 |
该实验得出的结论是_______________,能说明灰绿色是由Fe(OH)2表面吸附Fe2+引起的证据是____________。丙同学认为该实验方案不足以证明灰绿色是由Fe(OH)2表面吸附Fe2+引起的,还需补充的实验是________________,证明该假设成立。
(3)丙同学探究温度对氢氧化亚铁制备实验的影响:取少量灰绿色沉淀,在水浴中加热,颜色由灰绿变白,且有絮状白色沉淀下沉,原因为_____________。
(4)根据以上实验探究,若尽可能制得白色Fe(OH)2沉淀,需要控制的实验条件____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】含MgCl2、KCl、Na2SO4三种溶质的混合液中,已知其中含Cl﹣1.5mol,K+和Na+共1.5mol,Mg2+为0.5mol,则SO42﹣的物质的量为( )
A.1 mol
B.0.5 mol
C.0.25 mol
D.0.15 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】某有机物甲经水解可得乙,乙在一定条件下经氧化后可得丙,lmol丙和2mol甲反应得一种含氯的酯(C6H8O4Cl2)。由此推断有机物甲的结构简式为( )
A. Cl-CH2CHO B. HOCH2CH2Cl C. Cl-CH2COOH D. HOOC-COOH
查看答案和解析>>
科目: 来源: 题型:
【题目】CuCl2、CuCl广泛用于有机合成的催化剂。CuCl2容易潮解; CuCl白色粉末,微溶于水,溶于浓盐酸和氨水生成络合物,不溶于乙醇。
已知:
i.CuCl2+Cu+2HCl(浓)![]() 2H[CuCl2](无色)
2H[CuCl2](无色)![]() 2CuCl↓(白色)+2HCl
2CuCl↓(白色)+2HCl
ii.副反应:CuCl+H2O![]() CuOH+2HCl;CuCl+Cl—===[CuCl2]—
CuOH+2HCl;CuCl+Cl—===[CuCl2]—
(1)制取CuCl2装置如下:
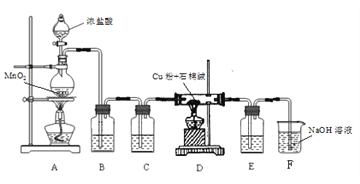
① A装置中发生反应的离子方程式是_________。
② C、E 装置中盛放的是浓硫酸,作用是_________。
③ B中选择饱和食盐水而不用蒸馏水的原因是_________。
(2)制取CuCl流程如下:
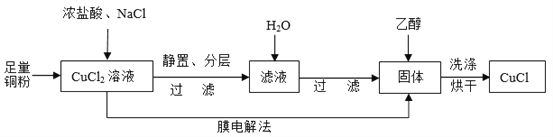
①反应①中加入NaCl的目的是_________;但是Cl—浓度过高,CuCl产率降低,原因是________________。
②CuCl在潮湿的环境中易被氧化为Cu2(OH)3Cl,反应的方程式为________________。
③利用膜电解法制取CuCl,阴极电极反应式为________________。
④用乙醇洗涤沉淀Y的原因为________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】热电厂用碱式硫酸铝[Al2(SO4)3Al2O3]吸收烟气中低浓度的二氧化硫。具体过程如下:
(1)碱式硫酸铝溶液的制备
往Al2(SO4)3溶液中加入一定量CaO粉末和蒸馏水,可生成碱式硫酸铝(络合物,易溶于水),同时析出生石膏沉淀[CaSO4·2H2O],反应的化学方程式为____。
(2)SO2的吸收与解吸。吸收液中碱式硫酸铝活性组分Al2O3对SO2具有强大亲和力,化学反应为:Al2(SO4)3·Al2O3(aq)+3SO2(g)![]() Al2(SO4)3·Al2(SO3)3(aq) △H<0。工业流程如下图所示:
Al2(SO4)3·Al2(SO3)3(aq) △H<0。工业流程如下图所示:
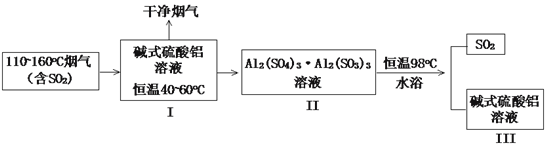
① 高温烟气可使脱硫液温度升高,不利于SO2的吸收。生产中常控制脱硫液在恒温40~60oC,试分析原因_____。
② 研究发现,I中含碱式硫酸铝的溶液与SO2结合的方式有2种:其一是与溶液中的水结合。其二是与碱式硫酸铝中的活性Al2O3结合,通过酸度计测定不同参数的吸收液的pH变化,结果如下图所示:
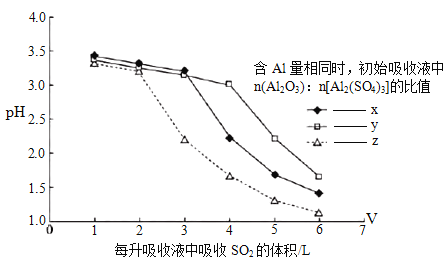
据此判断初始阶段,SO2的结合方式是____。
比较x、y、z的大小顺序_____。
③ III中得到再生的碱式硫酸铝溶液,其n(Al2O3):n[Al2(SO4)3]比值相对I中有所下降,请用化学方程式加以解释:____。
(3)解吸得到较纯的SO2,可用于原电池法生产硫酸。
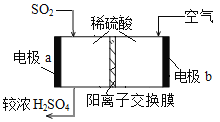
① 电极b周围溶液pH_____(填“变大”、“变小”或“不变”)
② 电极a的电极反应式是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W、Q都是短周期主族元素,其中Z原子的最高正价与最低负价的代数和为4;X与Z同族,Y与X同周期,Q原子的电子总数等于其电子层数的3倍,W与Y、Z不同周期;X、Y、Z三种元素的族序数之和为17。
(1)Z的简单离子结构示意图为__________________。
(2)写出含有10个中子的X原子的核素符号_____________。
(3)红热的Q单质可以与Z的最高价氧化物的水化物的浓溶液反应,写出该反应的化学方程式___________________。
(4)Y的气态氢化物与HC1在空气中相遇有白烟生成,写出白烟对应物质的电子式____________。
(5)X和Z两种元素相比较,非金属性较强的是(填元素名称)_______,可以验证该结论的是______(填写编号);
a.比较这两种元素的常见单质的沸点
b.比较这两种元素的单质与氢气化合的难易
c.比较这两种元素的气态氢化物的稳定性
(6)下列关于土述元素说法正确的是_________。
A.X、Y、Q都能与W形成10电子分子
B.Y的最高价氧化物对应水化物能与Y的简单氢化物反应生成盐
C.X可以分别与另外四种元素最多各形成两种氧化物
(7) Na在X2中燃烧所得产物的化学式是_______,该物质中存在的化学键类型有__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上由黄铜矿(主要成分CuFeS2,质量分数为90%)冶炼铜的主要流程如下:

己知:一定条件下,铝可以和某些金属氧化物反应置换金属
(1)高温焙烧前要将黄铜矿粉碎的目的是_________________。
(2)气体A中的大气污染物可选用下列试剂中的____________吸收。
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨水
(3)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在____(填离子符号),欲检验溶液中还存在Fe2+,所需试剂是_________。
(4)由泡铜冶炼粗铜的化学反应方程式为_________。
(5)某同学用铜、稀硫酸和H2O2制备CuSO4溶液,其化学反应方程式为_________,反应停止后除去溶液中过量的H2O2的简便方法是_____________。
(6)1.15吨该黄铜矿理论上可以得到含杂质10%的粗铜质量为_________kg(冶炼过程中铜损失忽略不计)。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程可用下图表示。下列关于海洋氮循环的说法正确的是
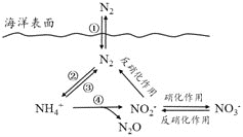
A. 海洋中的氮循环起始于氮的氧化
B. 海洋中的氮循环属于固氮作用的是③
C. 海洋中的反硝化作用一定有氧气的参与
D. 向海洋排放含NO3—的废水会影响海洋中NH4+的含量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com