
科目: 来源: 题型:
【题目】X2-与Y+离子都与Ar原子具有相同的核外电子排布,则下列叙述中正确的是( )
A.原子序数X>Y
B.离子半径X>Y
C.X和Y一定在同一周期
D.X是第IIA族元素,Y是第VIIA族元素
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关甲烷的说法中,不正确的是
A. 1mol甲烷中含有4mol C—H共价健
B. CH4、CCl4和CH3Cl都是正四面体结构
C. 光照条件下甲烷能与溴蒸气发生取代反应
D. 通常情况下,甲烷跟强酸、强碱、强氧化剂不反应
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,在某恒容密闭容器中进行反应X(g) + 3Y(g)![]() 2Z(g),若X、Y、Z起始浓度分别为c1 mol/L、c2 mol/L、c3 mol/L(c1、c2、c3均大于0),当反应达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是
2Z(g),若X、Y、Z起始浓度分别为c1 mol/L、c2 mol/L、c3 mol/L(c1、c2、c3均大于0),当反应达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是
A. c1:c2 = 1:3
B. 当4v(X)正= v(Y)逆时,该反应还在向正反应方向建立平衡
C. c1可能为0.1
D. X、Y的转化率相等
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.拆开1mol气态物质中某种共价键需要吸收的能量,就是该共价键的键能。下表是某些共价键的键能:根据右图中能量变化图,回答下列问题:
(1)图中:a=___________。
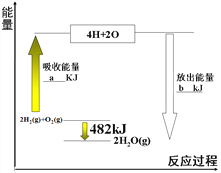
(2)表格中:X=__________。
共价键 | H-H | O=O | H-O |
键能/kJ ·mol-1 | 436 | 498 | X |
Ⅱ.如图,A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
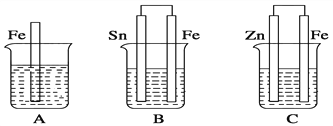
(1)A中反应的离子方程式为_____________________________。
(2)B中Sn极的电极反应式为____________________________。
(3)C中被腐蚀的金属是________,总反应的化学方程式为_________________________,
比较A、B、C中铁被腐蚀的速率,由快到慢的顺序为__________(填序号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。下列描述正确的是
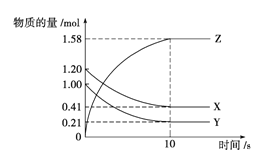
A. 反应在0~10 s内,用Z表示的反应速率为0.158 mol·L-1·s-1
B. 反应在0~10 s内,X的物质的量浓度减少了0.79 mol·L-1
C. 反应进行到10 s时,Y的转化率为79.0%
D. 反应的化学方程式为X(g)+Y(g)≒Z(g)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质的俗名与其化学式、用途都相符的是( )
A.烧碱、Na2CO3、制玻璃 B.小苏打、NaHCO3、治疗胃酸过多
C.苏打、NaOH、造纸 D.食盐、NaCl、化肥
查看答案和解析>>
科目: 来源: 题型:
【题目】分别向2L 0.5mol·L-1的KOH的溶液中加入适量的①浓硫酸、②稀醋酸、③稀盐酸,恰好完全反应的热效应分别为△H1、△H2、△H3 , 下列关系正确的是 ( )
A.ΔH1<ΔH3<ΔH2
B.ΔH1>ΔH2>ΔH3
C.ΔH1>ΔH2=ΔH3
D.ΔH1<ΔH2<ΔH3
查看答案和解析>>
科目: 来源: 题型:
【题目】对于某些离子的检验及结论正确的是( )
A. 加盐酸有无色气体产生,该气体能使澄清石灰水变浑浊,原溶液中一定有CO32﹣
B. 加氯化钡溶液有白色沉淀产生,再加盐酸,淀淀不消失,原溶液中一定有SO42﹣
C. 某溶液的焰色反应为黄色,则该溶液中一定有Na+
D. 某溶液中加入Na2CO3溶液后有白色沉淀,则该溶液中一定有Ca2+
查看答案和解析>>
科目: 来源: 题型:
【题目】数十年来,化学工作者对氮的氧化物、碳的氧化物做了广泛深入的研究并取得一些重要成果。
I.已知2NO(g)+O2(g)![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
第一步:2NO(g)![]() N2O2(g) (快) H1<0;v1正=k1正c2(NO) ;v1逆=k1逆c(N2O2)
N2O2(g) (快) H1<0;v1正=k1正c2(NO) ;v1逆=k1逆c(N2O2)
第二步:N2O2(g)+O2(g)![]() 2NO2(g) (慢) H2< 0; v2正=k2正c(N2O2)c(O2);v2逆=k2逆c2(NO2)
2NO2(g) (慢) H2< 0; v2正=k2正c(N2O2)c(O2);v2逆=k2逆c2(NO2)
①2NO(g)+O2(g)![]() 2NO2(g)的反应速率主要是由_______(填“第一步”或“第二步”)反应决定。
2NO2(g)的反应速率主要是由_______(填“第一步”或“第二步”)反应决定。
②一定温度,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=____________;升高温度,K值_______(填“增大”、“减小”或“不变”)。
2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=____________;升高温度,K值_______(填“增大”、“减小”或“不变”)。
II.利用CO2和CH4重整不仅可以获得合成气(主要成分为CO、H2),还可减少温室气体的排放。
(1)已知重整过程中部分反应的热化方程式为:
① CH4(g)=C(s)+2H2(g) ΔH>0
② CO2(g)+H2(g)=CO(g)+H2O(g) ΔH>0
③ CO(g)+H2(g)=C(s)+H2O(g) ΔH<0
固定n(CO2)=n(CH4),改变反应温度,CO2和CH4的平衡转化率见图甲。
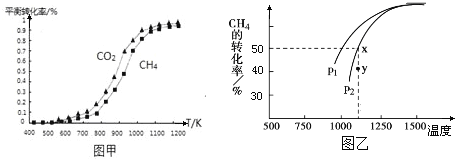
同温度下CO2的平衡转化率________(填“大于”或“小于”)CH4的平衡转化率,其原因是_______________________________________________。
(2)在密闭容器中通入物质的量均为0.1mol的CH4和CO2,在一定条件下发生反应CO2(g) + CH4(g)![]() 2CO(g) + 2H2(g),CH4的平衡转化率与温度及压强(单位Pa)的关系如图乙所示。则:
2CO(g) + 2H2(g),CH4的平衡转化率与温度及压强(单位Pa)的关系如图乙所示。则:
①压强:p1_____p2(填“>”、“=”、“<”,下同);y点:v(正)_____v(逆)。
②已知气体分压(p分)=气体总压(p总)×气体的物质的量分数。用平衡分压代替平衡浓度可以得到平衡常数Kp,求x点对应温度下反应的平衡常数Kp=__________________。
(3)一定条件下Pd-Mg/SiO2催化剂可使CO2“甲烷化”从而变废为宝,其反应机理如图丙所示。该反应的化学方程式为____________________________________________。

(4)CO常用于工业上冶炼金属,图丁是在不同温度下CO还原四种金属氧化物达平衡后气体中lg[c(CO)/c(CO2)]与温度(t)的关系曲线图。下列说法正确的是_________。
A.工业上可以通过增高反应装置来延长矿石和CO接触的时间,减少尾气中CO的含量
B.CO不适宜用于工业冶炼金属铬(Cr)
C.工业冶炼金属铜(Cu)时较低的温度有利于提高CO的利用率
D.CO还原PbO2的反应ΔH>0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com