
科目: 来源: 题型:
【题目】有七种物质:①甲烷、②苯、③聚乙烯、④1,3﹣戊二烯、⑤2﹣丁炔、⑥甲苯、⑦环己烯,既能使酸性高锰酸钾溶液褪色,又能使溴水因反应而褪色的是( )
A. ③④⑤ B. ④⑤⑦ C. ④⑤ D. ③④⑤⑦
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物的天然提取和人工合成往往得到的是混合物,假设给你一种这样的有机混合物让你研究, 一般要采取的几个步骤是
A. 分离、提纯→确定化学式→确定实验式→确定结构式
B. 分离、提纯→确定实验式→确定化学式→确定结构式
C. 分离、提纯→确定结构式→确定实验式→确定化学式
D. 确定化学式→确定实验式→确定结构式→分离、提纯
查看答案和解析>>
科目: 来源: 题型:
【题目】欲除去下列物质中的杂质(括号内物质为杂质),所用试剂不正确的是( )
A.KNO3溶液(K2SO4):适量Ba(NO3)2溶液
B.CaCO3粉末(CaCl2):过量盐酸
C.Cu粉(Zn粉):过量盐酸
D.CO2(O2):灼热的铜网
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)下表是第三周期部分元素氧化物和氟化物的熔点和摩氏硬度:
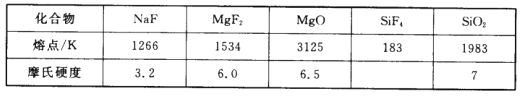
①两种氧化物MgO和SiO2的晶体类型分别是_________
②表格中几种氟化物熔点差异的主要原因是_________
③1mol SiO2中含有_______molSi—O键,Si和O原子配位数之比为____________
④NaF、MgF2、MgO、SiF4、SiO2中化学键能够代表分子真实组成的是________。
(2)![]() 比
比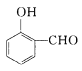 的沸点_______(填“高”或“低”)。
的沸点_______(填“高”或“低”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子在溶液中能大量共存的是( )
A. Na+、CO32-、SO42-、H+ B. K+、AlO2-、H+、Cl-
C. Fe2+、K+、OH-、NO3- D. Al3+、H+、NO3-、SO42-
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为周期表的一小部分,A、B、C、D的位置关系如图所示。且它们均为短周期元素,其中C元素的最外层电子数是电子层数的2倍,回答下列问题:

(1)在B、C、D最高价氧化物对应水化物中,B的化学式为______,其中酸性最强的是_____。
(2)在A、B、C、所形成氢化物中,A的化学式:___________,其中最稳定的是___________。
(3)写D的单质与C的氢化物反应的化学方程式________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中,不正确的是
A. 麦芽糖水解的产物只有葡萄糖B. 苯酚可用于环境消毒
C. 油脂水解可以制取高级脂肪酸D. 鸡蛋清遇醋酸铅后产生的沉淀能重新溶于水
查看答案和解析>>
科目: 来源: 题型:
【题目】在室温下,向100mL CuSO4饱和溶液中加入足量的经硫酸酸化的KI溶液,发生如下反应:2Cu2++4I-=2CuI↓+I2,反应完全后,用0.625mol/L的Na2S2O3溶液进行滴定,I2+2S2O32-=2I-+S4O62-,消耗了20 mL Na2S2O3溶液,计算:
(1)原饱和溶液中CuSO4的物质的量浓度;
(2)若CuSO4饱和溶液的密度为1.0 g/cm3,室温时CuSO4的溶解度是多少。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.下列实验操作中正确的是
A.分液时,分液漏斗下层液体从下端放出,上层液体从上口倒出
B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口
C.蒸发结晶时应将溶液直接蒸干
D.称量非腐蚀性药品应放在托盘天平左盘的称量纸上,砝码放在托盘天平右盘的称量纸上
Ⅱ.影响化学反应速率的因素很多,某学校化学小组用实验的方法进行探究。他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来探究影响化学反应速率的因素。甲同学的实验报告如下表:
实验步骤 | 现象 | 结论 |
①分别取等体积2mol/L的硫酸于试管中 ② | Mg产生气泡速率快于Fe,Cu无明显变化 | 金属性质越活泼,反应速率越快 |
(1)甲同学表中实验步骤②为 。
(2)甲同学的实验目的是探究 。
乙同学为了更精确地研究浓度对反应速率的影响,利用下图所示装置进行定量实验。
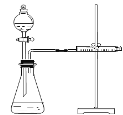
(3)乙同学在实验中应该测定的数据是 。
(4)乙同学完成实验应选用的实验药品是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】研究物质的微观结构,有助于人们理解物质变化的本质。请回答下列问题:
(1)O、Si、N元素的电负性由大到小的顺序是___________。C60和金刚石都是碳的同素异形体,二者中熔点较高的是____________。
(2)化合物A (H3BNH3)是一种潜在的储氢材料,它可由六元环状化合物(HB=NH)3通过
3CH4+2(HB=NH)3+ 6H2O→3CO2+6H3BNH3制得。下列有关的叙述不正确的是_______。(填标号)
A.反应前后碳原子的轨道杂化类型不变
B.CH4、H2O、CO2分子空间构型分别是:正四面体形、V形、直线形
C.第一电离能:N>O>C>B
D.化合物A中存在配位键
(3)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道的电子排布有关。一般地,若为d 0或d10排布时无颜色;若为d1~d9排布时有颜色;如[Cu(H2O)4]2+显蓝色。据此判断25号元素Mn形成的络合离子[Mn(H2O)6]2+ ________(填“有”或“无”)颜色 。
(4)H-C≡C-COOH分子内含有的σ键、π键的个数依次为_________,其中碳原子的杂化方式为_____。
(5)CO可以与金属铁形成配合物分子Fe(CO)5。Fe(CO)5在一定条件下发生分解反应:Fe(CO)5(s)=Fe(s)+5CO(g),反应过程中,断裂的化学键只有配位键,则形成的化学键类型是_______。
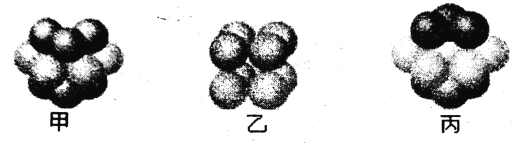
(6)某元素的原子的M能层为全充满状态,且N层电子只有一种运动状态,其单质晶体中微粒的堆积方式是下图中________(选填“甲”、“乙”或“丙”); 若该晶体中晶胞的边长为acm,则该晶体的密度为_____g /cm3(写出含a的表达式,用NA表示阿伏加德罗常数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com