
科目: 来源: 题型:
【题目】(8分)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)⑧的原子结构示意图为_________。
(2)②的气态氢化物分子的结构式为_______,②和⑦的气态氢化物的稳定性相比,其中较弱的是____(用该氢化物的化学式表示)。
(3)②、③的最高价含氧酸的酸性由强到弱的顺序是 (填化学式)。
(4)⑤、⑥元素的金属性强弱依次为___________(填“增大”、“减小”或“不变”)。
(5)④、⑤、⑥的形成的简单离子半径依次_________(填“增大”、“减小”或“不变”)。
(6)①、④、⑤元素可形成既含离子键又含共价键的化合物,写出它的电子式: ,形成的晶体是 晶体。
查看答案和解析>>
科目: 来源: 题型:
【题目】无水氯化铝是一种重要的化工原料,某研究性学习小组查阅资料后利用图1所示装置制备无水氯化铝(反应温度为450℃-500℃)。资料显示:氯化铝为无色透明晶体或白色而微带浅黄色的结晶性粉末,在178℃ 升华,在空气中能吸收水分,发生水解。
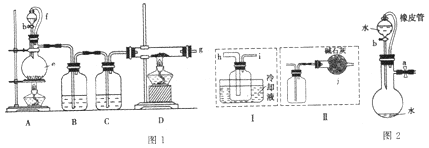
回答下列问题:
(1)某同学检验装置A部分的气密性,如图2所示,关闭图装置中的止水夹a后,开启活塞b,水不断往下滴,直至全部流入烧瓶。试判断:A部分装置是否漏气?____________ (填“漏气”、“不漏气”或“无法确定”),判断理由:____________。
(2)装置e的名称是_______________,装置B的作用是____________。
(3)某学习小组设计了以下两种实验方案:方案甲:g接装置I;方案乙:g接装置II。但是甲乙两个方案中虚线内装置均有不足之处,请你评价后填写下表。
方案 | 不足之处 |
甲 | ____________ |
乙 | ____________ |
(4)在上述(3)的评价基础上,请设计一个合理方案:_________________。
(5)A部分装置中发生反应生成氯气的离子方程式为______________,若生成标准状况下的氯气22.4L,需要10mol·L-1的浓盐酸的体积______400mL(填大于、小于或等于)。
查看答案和解析>>
科目: 来源: 题型:
【题目】10 mL某气态混合烃在80 mL O2中充分燃烧,得到体积为65 mL的混合气体(气体体积均在相同条件20℃时测定),则该混合物不可能是 ( )
A. 丙烷和丙烯 B. 乙烷和丙烯 C. 丙烯和丁炔 D. 丁烯和丙炔
查看答案和解析>>
科目: 来源: 题型:
【题目】将下列各组物质按单质、酸、碱、盐分类顺序排列,其中正确的是( )
A.水银、硫酸、烧碱、硫酸氢钠
B.碘酒、盐酸、烧碱、硫酸钡
C.氧气、硝酸、纯碱、胆矾
D.铁、醋酸、碱式碳酸铜、氯化铜
查看答案和解析>>
科目: 来源: 题型:
【题目】实验中,所选取的分离装置与对应原理都正确的是 ( )
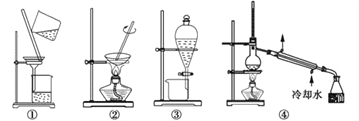
选项 | 目 的 | 装置 | 原 理 |
A | 氢氧化铁胶体的纯化 | ① | 胶体粒子不能通过滤纸,离子及小分子可以通过滤纸 |
B | 分离苯中的溴苯 | ③ | 苯(0.88 g/mL)和溴苯(1.5 g/mL)的密度不同 |
C | 粗盐提纯 | ①② | NaCl在水中的溶解度很大 |
D | 除去环己醇中的环烯 | ④ | 环己醇的沸点(161 ℃)与环己烯的沸点(83 ℃)相差较大 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】已知某气态烃1mol最多可与2molHCl发生加成反应,所得产物与Cl2发生取代反应时,若将氢原子全部取代,需要8mol Cl2,则该烃可能是( )
A.丙炔 B.乙炔 C.2-丁炔 D.2-丁烯
查看答案和解析>>
科目: 来源: 题型:
【题目】直接排放含SO2的烟气会形成酸雨,危害环境。某化学兴趣小组进行如下有关SO2性质和含量测定的探究活动。

(1)装置A中仪器a的名称为__________。若利用装置A中产生的气体证明+4价的硫元素具有氧化性,试用化学方程式表示该实验方案的反应原理________________。
(2)选用图4中的装置和药品探究亚硫酸与次氯酸的酸性强弱:
①甲同学认为按A→C→F→尾气处理顺序连接装置可以证明亚硫酸和次氯酸的酸性强弱,乙同学认为该方案不合理,其理由是_________________。
②丙同学设计的合理实验方案为:按照A→C→_________→F→尾气处理(填字母) 顺序连接装置。证明亚硫酸的酸性强于次氯酸的酸性的实验现象是_____________________。
③其中装置C的作用是__________。常温下,测得装置C中饱和NaHSO3溶液的pH≈5,则该溶液中所有离子的浓度由大到小的顺序为__________________。(已知0.1mol/L的H2SO3溶液pH >1)
(3)为了测定装置A残液中SO2的含量,量取10.00 mL残液于圆底烧瓶中,加热使SO2 全部蒸出,用20.00 mL0.0500 mol/L的KMnO4溶液吸收。充分反应后,再用0.2000mol/L的KI标准溶液滴定过量的KMnO4 ,消耗KI溶液15.00 mL。
已知:5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+
10I-+2MnO4-+16H+=2Mn2++5I2+8H2O
①残液中SO2的含量为_______g·L-1。
②若滴定过程中不慎将KI标准溶液滴出锥形瓶外少许,使测定结果_______(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列化学方程式中,可以用离子方程式 H++ OH- = H2O表示的是( )
A. 3HCl + Fe(OH)3 = FeCl3 + 3H2O
B. 2HCl + Cu(OH)2 = CuCl2 + 2H2O
C. H2SO4 + Ba(OH)2 = BaSO4 ↓+ 2H2O
D. HNO3 + KOH = KNO3 + H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于同分异构体数目的叙述不正确的是( )
A.甲苯苯环上的1个氢原子被含3个碳原子的烷基取代,所得产物有6种
B.已知丙烷的二氯代物有4种异构体,则其六氯代物的异构体数目也为4种
C.含有5个碳原子的某饱和链烃,其一氯代物有3种
D.菲的结构为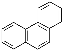 ,它与硝酸反应,可生成5种一硝基取代物
,它与硝酸反应,可生成5种一硝基取代物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com