
科目: 来源: 题型:
【题目】为研究哈伯法合成氨反应,T℃时,在容积为2 L恒容容器中通入4 mol N2和12mol H2,反应如下: N2(g)+3H2(g) ![]() 2NH3(g) △H=-92.0kJmol-1,相关键能数据如下:
2NH3(g) △H=-92.0kJmol-1,相关键能数据如下:
N≡N | H-H | N-H | |
键能数据( kJ/mol) | 946 | 436 | X |
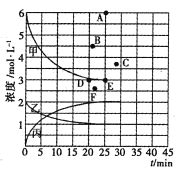
若25min时反应达到平衡,各物质浓度随时间变化曲线如下图中甲、乙、丙。回答下列问题:
(1)0-25min内,反应的平均速率v(H2)为_________;表中X=_________________。
(2)T℃时,该反应的平衡常数K=_____________ (用最简分数表达)。
(3)T℃时,若起始充入8mol N2和24 mol H2,则反应刚达到平衡时,表示c( H2)在右图中相应的点为_____(填字母)。
(4)以煤为主要原料的合成氨工业中,原料气氢气常用下述方法获得:
①C(s) +H2O(g)![]() CO(g) +H2(g) △H1
CO(g) +H2(g) △H1
②CO(g) +H2O(g)![]() CO2(g) +H2(g) △H2
CO2(g) +H2(g) △H2
若已知CO和H2的燃烧热分别为283 kJ·mol-l和285.8kJ·mol-l;H2O( g) =H2O(1) △H =-44kJ·mol-l 则△H2=_______________。
(5)氨气是生产硝酸的重要原料,其过程如下:
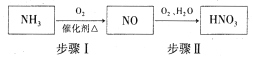
写出步骤I的化学方程式:_________________。
(6)下图是科学家提出的利用电解法常温常压下由氮气、氢气合成氨的示意图:
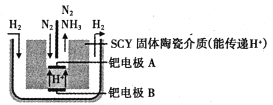
由图可知,钯电极B是电解池的________(填“阴极”或“阳极”);钯电极A上的电极反应式为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验操作或记录正确的是( )
A. 常温常压下测得1molN2的质量为28g
B. 用量筒测得排水法收集制得的氢气体积为50.28mL
C. 将洗净的锥形瓶和容量瓶放入烘箱中烘干
D. 用托盘天平称取2.50g胆矾,受热充分失水后,固体质量减轻0.90g
查看答案和解析>>
科目: 来源: 题型:
【题目】从镍矿石尾矿中提取NiSO4是解决我国镍资源匮乏的一条重要途径,已知该过程如下:

表1:各物质的Ksp数据如下表:
物质 | MnS | NiS | PbS | CuS | Ni(OH)2 |
Ksp | 2.5×10-13 | 1.1×10-21 | 8.0×10-28 | 6.3×10-36 | 2.0×10-15 |
表2:滤液A中各金属离子的含量如下表:
成分 | Ni2+ | Fe3+ | Fe2+ | Mn2+ | Cu2+ | Pb2+ | …… |
3.80 | 4.80 | x | 0. 20 | 0.15 | <0.001 | …… |
根据以上信息,回答下列问题:
(1)步骤I酸浸之前需将矿石粉碎,目的是____________。
(2)若杂质离子的浓度c≤1.0×10-5mol/L即可认定沉淀完全,则步骤Ⅱ中当Pb2+“恰好沉淀完全时,溶液中硫离子的浓度c(S2-)=_____________
(3)常温下进行步骤Ⅲ的目的是为了除去铁和锰元素,已知除铁元素的离子反应如下:
2Fe2++ ClO - +5H2O=2Fe( OH)3↓+Cl-+4H+
此时Mn2+的氧化产物为MnO2,写出除锰元素的离子方程式______________。
(4)为测定滤液A中Fe2+离子的含量,(每升溶液中含有的亚铁离子的质量,以g/L表示)每次移取20.00 mL待测液,并用0.02 mol/L的KMnO4溶液滴定,若已知其他离子均不反应,且三次滴定平均消耗KMnO4溶液18. 00mL,则x的值为________(精确到小数点后两位)。
(5)所得Ni(OH)2是制造镍镉电池的重要原料,镍镉电池工作原理如下:
Cd+2NiO(OH) +2H2O![]() Cd(OH)2+2Ni(OH)2
Cd(OH)2+2Ni(OH)2
则随着放电的进行,正极区pH______(填“增大”、“减小”或“不变”);充电时阴极电极反应式为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是用浓硝酸、铜片、水等试剂探究浓、稀硝酸的强氧化性并观察还原产物的实验装置。
Ⅰ.浓硝酸的强氧化性实验
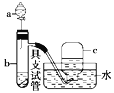
将铜片置于具支试管的底部,在分液漏斗中加入约5 mL浓硝酸,往具支试管中放入约2 mL浓硝酸,用排水法收集产生的气体。
(1)具支试管中发生反应的化学方程式:___________________________________________。
(2)实验中观察到能证明浓硝酸具有强氧化性的现象_________________。
Ⅱ.稀硝酸的强氧化性实验
(3)上述反应完成后,欲进一步证明稀硝酸也具有强氧化性,紧接的简便、合理的实验操作是________________________________________________________________________。
(4)能证明稀硝酸与铜反应产生NO的实验现象是____________________(填写序号)。
A.c中收集到无色气体
B.c中收集到的无色气体接触空气后变为红棕色
C.b中产生的无色气体接触空气后变为红棕色
Ⅲ.实验反思
(5)利用该装置先进行铜与浓硝酸反应,再进行铜与稀硝酸反应的实验,其好处是________________________________________________________________________。
Ⅳ.问题讨论
用等质量的铜片与等体积的浓硝酸、稀硝酸(硝酸均过量)反应时,发现反应后所得溶液前者呈绿色,后者呈蓝色。对此有两种看法:
①两者颜色不同的原因是因为Cu2+浓度差异引起的。
②前者溶液呈绿色,是因为生成的红棕色NO2溶解于溶液中引起的。
(6)你认为上述看法________(填“①”或“②”)合理。若是①合理,说明理由,若是②合理,设计一个简单实验证明:______________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组物质中,相互间一定互为同系物的是
A. 邻二甲苯和对二甲苯 B. C4H8 O2和C3H6O2
C. C4H10和C20H42 D. C6H5-OH和C6H5-CH2-OH
查看答案和解析>>
科目: 来源: 题型:
【题目】法医常用马氏试砷法检验是否砒霜( As2O3)中毒,涉及的反应如下:
I:6Zn+As2O3+12HCl=6ZnCl2+2AsH3(砷烷)↑+3H2O
Ⅱ:2AsH3=2As(黑色砷镜)+3H2
(1)写出砷的基态原子价电子排布图______________。
(2)砷烷的空间结构为_______;砷烷中心原子杂化方式为________。
(3)砷烷同族同系列物质相关性质如下表:
NH3 | PH3 | AsH3 | SbH3 | |
熔点/℃ | -77.8 | -133.5 | -116.3 | -88 |
沸点/℃ | -34.5 | -87.5 | -62.4 | -18.4 |
从PH3→AsH3→SbH3熔沸点依次升高的原因是_________;NH3分子例外的原因是_______。
(4)第一电离能数据I(As)>I(Se),可能的原因是_____________。
(5)砷与铟(In)形成的化合物(X)具有优良的光电性能,广泛应用于光纤通信用激光器,其晶胞结构如图所示,则其化学式为______;晶胞边长a= 666.67pm,则其密度为_____g/cm3(边长a可用![]() 近似计算,设NA=6.0×1023/mol)。
近似计算,设NA=6.0×1023/mol)。

查看答案和解析>>
科目: 来源: 题型:
【题目】关于35℃的0.1mol/L NaOH溶液,以下表述错误的是( )
A.Kw>1×10﹣14
B.水电离的c(H+)>1×10﹣13 mol/L
C.pH>13
D.c(OH﹣)=c(H+)+c(Na+)
查看答案和解析>>
科目: 来源: 题型:
【题目】由2-溴丙烷为原料制取1,2-丙二醇(HOCH2-CHOH-CH3),需要经过下列哪几步反应( )
A. 消去-取代-加成B. 取代-消去-加成
C. 消去-加成-水解D. 水解-取代-取代
查看答案和解析>>
科目: 来源: 题型:
【题目】直接甲醇燃料电池以其供电量大、持续时间长而极具发展前景,其工作原理如右图。下列关于它的说法正确的是
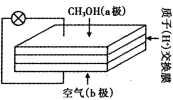
A. 电子自b极经外电路流向a极
B. b极的电极反应式为O2 +4e - +4H+= 2H2O
C. 质子交换膜中的H+流向a极
D. 用该电池电解CuSO4溶液,理论上每生成0.1 molCu消耗氧气1.12 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com