
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.摩尔质量就等于物质的相对分子质量
B.摩尔质量就是物质相对分子质量的6.02×1023倍
C.HNO3的摩尔质量是63 g
D.硫酸和磷酸的摩尔质量相等
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组进行有关卤素及其化合物的制备和性质探究实验,请同学们参与他们的实验并回答下列问题。
【实验一】氯气的制备与性质
(1)用下图所示的实验装置来制备纯净、干燥的氯气,并完成它与金属铁的反应。每个虚线框表示一个单元装置,其中有错误的是_____(填字母序号)。
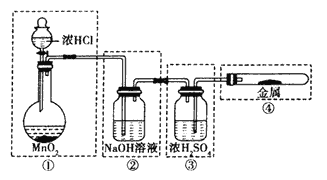
A.只有②和④ B.只有② C.只有①和③ D.②③④
【实验二】卤素化合物的性质实验探究
已知氯化亚铁的熔点674℃、沸点1023℃;三氯化铁在100℃左右时升华,易溶于水并且有强烈的吸水性。在500℃条件下氯化亚铁与氧气可能发生多种反应,如:12FeCl2+3O2![]() 2Fe2O3+8FeCl3、4FeCl2+3O2
2Fe2O3+8FeCl3、4FeCl2+3O2![]() 2Fe2O3+4Cl2等。该兴趣小组选用以下部分装置(夹持装置省略,装置不可重复选用)进行氯化亚铁与氧气反应产物的探究。
2Fe2O3+4Cl2等。该兴趣小组选用以下部分装置(夹持装置省略,装置不可重复选用)进行氯化亚铁与氧气反应产物的探究。

(2)实验装置的合理连接顺序为:A→____________→F。
(3)A装置中反应的化学方程式为________________。
(4)当加热装置中充分反应后,余下的固体是_________;本套实验装置的主要缺点是_____________。
(5)利用反应生成的FeCl3设计实验证明Fe(OH)3是弱碱,实验方案为____________。
【实验三】卤素化合物反应实验条件控制探究
(6)在不同实验条件下KClO3可将KI氧化为I2或KIO3。该小组设计了一系列实验来研究反应条件对反应物的影响,其中某一实验的数据记录如下(实验控制在室温下进行):
试管标号 | 1 | 2 | 3 | 4 |
0.20mol·L-1KI溶液/mL | 1.0 | 1.0 | 1.0 | 1.0 |
KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
6.0mol/L-1H2SO4/mL | 0 | 3.0 | 6.0 | 9.0 |
蒸馏水/mL | 9.0 | 6.0 | 3.0 | 0 |
实验现象 |
①该组实验的目的是________________________。
②设计1号试管实验的作用是_______________________。
③若2号试管实验现象为“反应后溶液呈黄色”,取少量该溶液加入淀粉溶液显蓝色;假设氧化产物唯一,还原产物为KCl,则此反应的离子方程式为__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】若某基态原子的外围电子排布为4d15s2,则下列说法正确的是( )
A. 该元素位于周期表第5周期第IB族B. 该元素原子核外有5个电子层
C. 该元素原子最外层共有3个电子D. 该元素原子M层上共有8个电子
查看答案和解析>>
科目: 来源: 题型:
【题目】随着人们生活节奏的加快,方便的小包装食品已被广泛接受。为了防止中秋月饼等富脂食品氧化变质,延长食品的保质期,在包装袋中常加入抗氧化物质,下列不属于抗氧化物质的是( )
A.硫酸亚铁 B.还原铁粉 C.亚硫酸钠 D.生石灰
查看答案和解析>>
科目: 来源: 题型:
【题目】在“HI(s)→HI(g)→H2和I2”的变化过程中,被破坏的作用力依次是( )
A. 范德华力、范德华力B. 共价键、离子键
C. 范德华力、共价键D. 共价键、共价键
查看答案和解析>>
科目: 来源: 题型:
【题目】有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
实验 装置 |
装置一 |
装置二 |
装置三 |
装置四 |
部分实验现象 | a极质量减小,b极质量增大 | b极有气体产生,c极无变化 | d极溶解,c极有气体产生 | 电流从a极 流向d极 |
由此可判断这四种金属活动性顺序是( )
A. a>b>c>d B. b>c>d>a C. a>b>d>c D. d>a>b>c
查看答案和解析>>
科目: 来源: 题型:
【题目】“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯。回答下列问题:
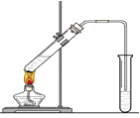
(1)写出制取乙酸乙酯的化学反应方程式___________________________。
(2)浓硫酸的作用是:①______________;②_______________。
(3)饱和碳酸钠溶液的主要作用是:
①______________________、
②______________________、
③____________________。
(4)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止__。
(5)若要把制得的乙酸乙酯分离出来,应采用的实验操作是_______。
(6)做此实验时,有时还向盛乙酸和乙醇的试管里加入几块碎瓷片,其目的是____。
(7)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号)______。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
查看答案和解析>>
科目: 来源: 题型:
【题目】同学们已经学习了几种典型的有机化学反应类型——取代反应、加成反应、酯化反应。写出下列反应的化学反应方程式,并判断其反应类型。
①乙醇与金属钠反应:_____________________________,属于___________反应;
②由苯制取硝基苯:_______________________________,属于____________反应;
③由苯制取环己烷:_______________________________,属于____________反应;
④乙烯使溴水褪色:_______________________________,属于____________反应。
查看答案和解析>>
科目: 来源: 题型:
【题目】钛矿工业中的酸性废水富含Ti、Fe等元素,其综合利用如下:
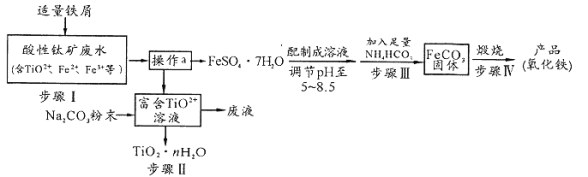
已知:TiO2+易水解,只能存在于强酸性溶液中。
(1)TiO2+钛的化合价为
(2)步骤I中检验钛矿废水中加入铁屑是否足量的试剂是 。
(3)操作a是蒸发浓缩、冷却结晶、 。
(4)步骤Ⅲ中发生反应的化学方程式为____________;反应温度一般需控制在35℃以下,其目的是 。
(5)已知![]() s。步骤Ⅲ中,FeCO3达到溶解平衡时,若室温下测得溶液的pH为8.5,c(Fe2+)=1×10-6 mol/L。试判断所得的FeCO3中________(填“有”或“没有”)Fe(OH)2;步骤Ⅳ中,为了得到较为纯净的Fe2O3,除了适当的温度外,还需要采取的措施是 。
s。步骤Ⅲ中,FeCO3达到溶解平衡时,若室温下测得溶液的pH为8.5,c(Fe2+)=1×10-6 mol/L。试判断所得的FeCO3中________(填“有”或“没有”)Fe(OH)2;步骤Ⅳ中,为了得到较为纯净的Fe2O3,除了适当的温度外,还需要采取的措施是 。
(6)向“富含TiO2+溶液”中加入Na2CO3粉末得到固体TiO2·nH2O。请结合原理和化学用语解释其原因 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com