
科目: 来源: 题型:
【题目】有机酸种类繁多,广泛分布于中草葯的叶、根、特别是果实中,是有机合成、工农业生产的重要原料,请回答下列有关问题:
(1)乙酸是合成乙酸乙酯的重要原料,制备原理如下:
CH3COOH(l)+ C2H5OH(l)![]() CH3COOHC2H5(l)+H2O(l) △H=-8.62kJ/mol
CH3COOHC2H5(l)+H2O(l) △H=-8.62kJ/mol
已知:CH3COOH、C2H5OH和CH3COOC2H5的沸点依次为118℃、78 ℃和77℃。在其他条件相同时,某研究小组进行了多次实验,实验结果如图所示:

①该研究小组的实验目的是________________。60℃下反应40min与70℃下反应20min相比,前者的平均反应速率___________后者(填“小于”、“等于”或“大于”)。
②如图所示,反应时间为40min、温度超过80℃时,乙酸乙酯产率下降的原因可能是___________;
③利用此原理制得的乙酸乙酯粗品中常含有一定量的乙酸、乙醇以及微量的硫酸,提纯时可向粗品中加入__________溶液进行充分洗涤,分离出有机层,并加入无水硫酸钠干燥,最后经过__________、_______两步操作即可得到纯品。
(2)乙二酸俗名草酸(二元弱酸,结构简式:HOOC—COOH),被广泛的应用于抗生素类药物的合成。
①实验室中经常利用酸性KMnO4溶液滴定法测其纯度。已知草酸与酸性KMnO4溶液反应过程有无色无味气体产生,且KMnO4溶液紫色褪去,写出草酸与酸性KMnO4溶液反应的离子方程式_____________________;
②资料表明:25℃时草酸的电离平衡常数Ka1=6.0×10-2;Ka2=6.4×10-5;据此分析,室温时草酸氢钾(KHC2O4)的水解反应平衡常数Kh=________(单位省略,计算结果保留两位有效数字),其溶液中c(H2C2O4)________c(C2O42-)(填“小于”、“等于”或“大于”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组离子,能在溶液中大量共存的是
A. K+、H+、SO42、OHB. Na+、Ca2+、NO3、CO32
C. Na+、H+、Cl、CO32D. Na+、Cu2+、Cl、SO42
查看答案和解析>>
科目: 来源: 题型:
【题目】在某无色透明的酸性溶液中,能共存的离子组是( )
A.Na+、Mg2+、Cl-、OH-
B.H+、Ca2+、Na+、NO3-
C.Cu2+、K+ 、SO42-、NO3-
D.Na+、SO42-、OH-、Ca2+
查看答案和解析>>
科目: 来源: 题型:
【题目】恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示:[已知:2SO2(g)+O2(g) ![]() 2SO3(g);△H=-196.9kJ/mol]
2SO3(g);△H=-196.9kJ/mol]
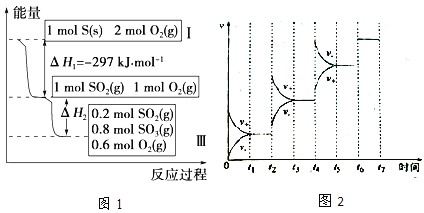
请回答下列问题:
(1)写出能表示硫的燃烧热的热化学方程式:_______________________;△H2=_______________;
(2)恒温恒容时,1molSO2和2molO2充分反应,放出热量的数值比|△H2|______(填 “大”、“小”或“相等”).
(3)恒容条件下,下列措施中能使n(SO3)/n(SO2)增大的有______。
a.升高温度 b.充入He气 c.再充入1molSO2(g)和1molO2(g) d.使用催化剂
(4)某SO2(g)和O2(g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间的关系如图2所示,若不改变SO2(g)和O2(g)的量,则图中t4时引起平衡移动的条件可能是______;图中表示平衡混合物中SO3的含量最高的一段时间是______。
(5)含硫废弃的脱硫减排是减少大气中含硫化合物污染的关键,工业脱除废气中SO2的原理如下:
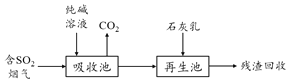
①用纯碱溶液吸收SO2,将其转化为HSO3-,该反应的离子方程式为___________________________;
②若石灰乳过量,将其产物再导入吸收池,其中可用于吸收SO2的物质的电子式是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表1是常温下几种弱酸的电离平衡上述(Ka)和弱碱的电离平衡常数(Kb),表2时常温下几种难(微)溶物的溶度积常数(Kap)
表1 | |
酸或碱 | 电离常数(Ka或Kb) |
CH3COOH | 1.8×10-5 |
HIO3 | 1.7×10-1 |
HCN | 5×10-10 |
HClO | 3×10-8 |
NH3H2O | 1.8×10-5 |
表2 | |
难(微)溶物 | 溶度积常数(Ksp) |
BaSO4 | 1×10-10 |
BaCO3 | 2.6×10-9 |
请回答下面问题:
(1)上述四种酸中,酸性最强的是______________(用化学式表示)。下列能使醋酸溶液中CH3COOH的电离度增大,而电离常数不变的操作是______(填序号)。
A.升高温度 B.加水稀释 C.加少量的CH3COONa固体 D.加少量冰醋酸
(2)HCOONH4的水溶液呈_______(选填“酸性”、“中性”、“碱性”),写出HCOONH4水解的离子反应方程式____________。
(3)物质的量1:1的NaCN和HCN的混合溶液,其pH>7,该溶液中离子的浓度从大到小排列为___。
(4)工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如:BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量的BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,最终 SO42-物质的量浓度达到0.05mol·L-1,则此时溶液中CO32-物质的量浓度应_____________mol·L-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述中正确的是
A. 以非极性键结合起来的双原子分子一定是非极性分子 B. 在所有分子中都存在化学键
C. σ键一定比π键强度大 D. s-s σ键与p-p σ键的电子云形状对称性不相同
查看答案和解析>>
科目: 来源: 题型:
【题目】以甲醇燃料电池(KOH电解质)为电源,在实验室中模拟铝制品表面“钝化”处理的过程。实验中,通电一段时间后可观察到铝电极逐渐失去光泽,并出现细小气泡,装置如图所示,下列说法正确的是
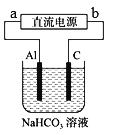
A. 燃料电池b电极上发生的反应为:CH4O-6e-+H2O=6H++CO2↑
B. 电解池中石墨电极做阴极,发生反应为:2H++2e-=H2↑
C. 电解池中Al电极上的反应为:Al-3e-+3HCO3-=AI(OH)3↓+3CO2↑
D. 理论上毎生成19.5 g沉淀,标准状况下a电极上消耗掉O2 2.1 L
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )。
A.NaCl晶体中含有Na+、Cl-,所以NaCl晶体能导电
B.CO2溶于水能导电,所以CO2是电解质
C.BaSO4难溶于水, BaSO4是非电解质
D.Cl2的水溶液能够导电,但Cl2既不是电解质也不是非电解质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com