
科目: 来源: 题型:
【题目】A、B、C、D、E是相邻三个周期中的五种元素,它们的原子序数依次增大,B、C、D属同一周期,A 、E在周期表中处于同一纵行。己知:
①除A外,各元素原子的内层均已填满电子,其中B的最外层有4个电子;
②A与B可以组成最简单的有机物,B与C可以组成两种中学化学中常见的气体;
③D与E生成离子化合物,其离子的电子层结构相同。回答:
(1) A为 元素,B为 元素,C为 元素,D为 元素,E为 元素 (填元素名称)。
(2) C元素在周期表中属 周期 族元素,原子结构简图为 。
(3) 用电子式表示D与E形成化合物的过程____________________________________,D与B形成的化合物的电子式 .
查看答案和解析>>
科目: 来源: 题型:
【题目】下列分子或离子在指定的分散系中能大量共存的一组是( )
A. 银氨溶液:Na+、K+、NO3-、NH3·H2O
B. 空气:C2H2、CO2、SO2、NO
C. 氢氧化铁胶体:H+、K+、S2-、Br-
D. 高锰酸钾溶液:H+、Na+、SO42-、HCHO
查看答案和解析>>
科目: 来源: 题型:
【题目】下列表述正确的是( )
A.氧化铁是一种碱性氧化物,常用作红色油漆和涂料
B.在医疗上碳酸钠、氢氧化铝均可用于治疗胃酸过多
C.Na2O2与水反应,红热的Fe与水蒸气反应均能生成碱
D.人造刚玉熔点很高,可用作高级耐火材料,主要成分是SiO2
查看答案和解析>>
科目: 来源: 题型:
【题目】在HF、H2O、NH3、CS2、CH4、H2O2、N2分子中:(将所选的物质化学式填入空白)
(1)以非极性键结合的非极性分子是___________;
(2)以极性键相结合,具有直线型结构的非极性分子是___________;
(3)以极性键相结合,具有正四面体结构的非极性分子是___________;
(4)以极性键相结合,具有三角锥型结构的极性分子是___________;
(5)以极性键相结合,具有V型结构的极性分子是___________;
(6)以极性键相结合,而且分子极性最大的是___________;
(7)与N2O互为等电子体的是_______________;
(8)含有非极性键的极性分子是_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述中正确的是( )
A.FeCl3溶液、Fe(OH)3胶体与Fe(OH)3沉淀的本质区别是有没有丁达尔效应
B.根据分散系的稳定性的大小将混合物分为胶体、溶液和浊液
C.根据是否具有丁达尔效应, 将分散系分为溶液、浊液和胶体
D.胶体、分散系、混合物概念间的从属关系可用下图表示
查看答案和解析>>
科目: 来源: 题型:
【题目】伦敦奥运火炬采用的是环保型燃料——丙烷,其燃烧时发生反应的化学方程式为C3H8(g)+5O2(g)![]() 3CO2(g)+4H2O(l)。下列说法中不正确的是( )
3CO2(g)+4H2O(l)。下列说法中不正确的是( )
A. 火炬燃烧时化学能只转化为热能
B. 所有的燃烧反应都会释放热量
C. 1 mol C3H8(g)和5 mol O2(g)所具有的总能量大于3 mol CO2(g)和4 mol H2O(l)所具有的总能量
D. 丙烷完全燃烧的产物对环境无污染,故丙烷为环保型燃料
查看答案和解析>>
科目: 来源: 题型:
【题目】(14分)二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放。
1.在一定温度下的2L固定容积的密闭容器中,通入2 molCO2和3mol H2,发生的反应为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),△H=-akJ·mol-1(a>0), 测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g),△H=-akJ·mol-1(a>0), 测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
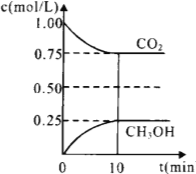
①能说明该反应已达平衡状态的是________。
A.CO2的体积分数在混合气体中保持不变
B.混合气体的平均相对分子质量不随时间的变化而变化
C.单位时间内每消耗1.2mol H2,同时生成0.4molH2O
D.反应中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变
②下列措施中能使![]() 增大的是________(选填编号)。
增大的是________(选填编号)。
A.升高温度
B.恒温恒容下充入He(g)
C.将H2O(g)从体系中分离
D.恒温恒容再充入2 mol CO2和3 mol H2
③计算该温度下此反应的平衡常数K=_________。若改变条件 (填选项),可使K=1。
A.增大压强 B.增大反应物浓度 C.降低温度 D.升高温度 E.加入催化剂
(2)某甲醇燃料电池原理如图1所示。
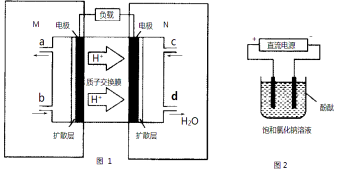
①M区发生反应的电极反应式为______________________ _________。
②用上述电池做电源,用图2装置电解饱和食盐水(电极均为惰性电极),则该电解反应的总反应的离子方程式为: 。假设溶液体积为300mL,当溶液的pH值变为13时(在常温下测定),理论上消耗甲醇的质量为______________(忽略溶液体积变化)。
(3)有一种用CO2生产甲醇燃料的方法:
已知:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
CH3OH(g)=CH3OH(l) △H=-b kJ·mol-1;
2H2(g)+O2(g)=2H2O(g) △H=-c kJ·mol-1;
H2O(g)=H2O(l) △H=-d kJ·mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:________________________ _________。
查看答案和解析>>
科目: 来源: 题型:
【题目】O3能吸收有害紫外线,保护人类赖以生存的空间。O3分子的结构如图,呈V型,键角116.5℃。三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键——三个O原子均等地享有这4个电子。请回答:
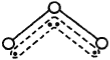
O3的分子结构
(1)臭氧与氧气的关系是___________。
(2)选出下列分子中与O3分子属于等电子体的是 。
A.H2O B.CO2 C.SO2 D.BeCl2
(3)分子中某原子有1对没有跟其他原子共用的价电子叫孤对电子,那么O3分子有_______ 对孤对电子。
(4)O3与O2间的转化是否为氧化还原反应___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】尿素[CO(NH2)2]是一种高效化肥,也是一种化工原料。
(1)恒温恒容下,在某密闭容器中充入CO(NH2)2和H2O,在120℃、催化剂作用下发生反应:CO(NH2)2 (s) + H2O(g)![]() 2 NH3(g)+CO2(g) △H >0。
2 NH3(g)+CO2(g) △H >0。
关于该反应的下列说法正确的是____。
A.混合气体的平均相对分子质量不再改变,可以作为化学平衡到达的标志
B.在平衡体系中充入He可使H2O的体积分数增大
C.降低温度使CO(NH2)2的转化率增大
D.达到平衡后,再充入少量CO(NH2)2, H2O的转化率不变
(2)一定条件下,某密闭容器中充入等物质的量的NH3和CO2,发生反应:CO2(g) +2NH3(g)![]() CO (NH2)2 (s) +H2O(g),混合气体中NH3的体积分数[φ(NH3)]随时间变化关系如图所示。
CO (NH2)2 (s) +H2O(g),混合气体中NH3的体积分数[φ(NH3)]随时间变化关系如图所示。

则a点的正反应速率V正(CO2)____ b点的逆反应速率V逆(CO2)(填“>”、“=”或“<”);氨气的平衡转化率是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com