
科目: 来源: 题型:
【题目】下列实验操作或设计中,可行的是( )
A. CO2通入足量BaCl2溶液中,产生白色沉淀
B. 除去O2中混有的H2,可将气体通过灼热CuO
C. 利用分液斗可分离酒精和氯化钠的混合物
D. 加稀盐酸后过滤,除去铜扮中没有的少量镁粉和铝粉
查看答案和解析>>
科目: 来源: 题型:
【题目】为实现实验目的,选用的装置、实验操作均正确的是( )
实验目的 | 实验步骤和装置 | |
A | 验证SO2具有漂白性 | 将SO2通入氢氧化钠的酚酞试液中 |
B | 探究温度对反应速率的影响 | 不同温度下,取0.1 mol/LKI 溶液,向其中先加入淀粉溶液,再加入0.1 mol/L 硫酸,记录溶液出现蓝色的时间 |
C | 验证牺牲阳极的阴极保护法 |
往铁电极附近滴加铁氰化钾溶液 |
D | 检验蔗糖水解产物具有还原性 | 向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,再向其中加入新制的Cu(OH)2,加热3-5min。 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,0.1 mol/L的HA溶液中![]() =1010,0.01 mol/L的BOH溶液pH=12。请回答下列问题:
=1010,0.01 mol/L的BOH溶液pH=12。请回答下列问题:
(1)HA是_________(填“强电解质”或“弱电解质”,下同),BOH是__________。
(2)HA的电离方程式是_______________________________________。
其中由水电离出的c(H+)=________mol/L
(3)在加水稀释HA的过程中,随着水量的增加而减小的是_______(填字母)。
A.![]()
B.![]()
C.c(H+)与c(OH-)的乘积
D.c(OH-)
(4)将等体积等物质的量浓度的HA溶液和BOH溶液混合后的溶液呈 性,请用离子方程式解释其原因_____________,混合溶液中各离子浓度由大到小的顺序是 。
(5)常温下pH=12的BOH溶液100mL,加0.01mol/L NaHSO4使溶液的pH为11。(混合溶液体积变化忽略不计),应加_________mL(保留到小数点后一位)
查看答案和解析>>
科目: 来源: 题型:
【题目】电化学在日常生活中用途广泛,图甲是镁——次氯酸钠燃料电池,电池总反应为:Mg+ClO-+H2O=Cl-+Mg(OH)2↓,图乙是含![]() 的工业废水的处理。下列说法正确的是( )
的工业废水的处理。下列说法正确的是( )

A. 图乙中![]() 向惰性电极移动,与该极附近的OH-结合转化成Cr(OH)3除去
向惰性电极移动,与该极附近的OH-结合转化成Cr(OH)3除去
B. 图甲中发生的还原反应是Mg2++ClO-+H2O+2e-=Cl-+Mg(OH)2↓
C. 图乙电解池中,若有0.84g阳极材料参与反应,则阴极会有3.36L的气体产生
D. 若图甲燃料电池消耗0.36g镁产生的电量用以图乙废水处理,理论上可产生1.07g氢氧化铁沉淀
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式方程式中正确的是
A.NaHCO3溶液中HCO3-水解:HCO3-+ H2O ![]() H2CO3+OH-
H2CO3+OH-
B.AlCl3溶液中Al3+水解:Al3++3H2O = Al(OH)3↓+3H+
C.NaHS溶液中HS-水解:HS-+H2O ![]() H3O++S2-
H3O++S2-
D.碳酸溶液中H2CO3的电离:H2CO3 ![]() 2H++ CO32-
2H++ CO32-
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下,二氧化硫和氧气发生如下反应:
2SO2(g)+O2(g)![]() 2SO3(g)+Q (Q>0)
2SO3(g)+Q (Q>0)
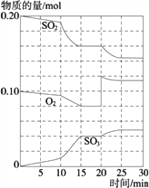
(1)写出该反应的化学平衡常数表达式K=_________.
(2)降低温度,该反应K值_________,二氧化硫转化率_________,正反应速度_________.(以上均填增大、减小或不变)
(3)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是_________.
据图判断,反应进行至20 min时,曲线发生变化的原因_____________________(用文字表达);10 min到15 min的曲线变化的原因可能是_________(填写编号).
A.加了催化剂 B.缩小容器体积
C.降低温度 D.增加SO3的物质的量
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,水溶液中H+和OH-的浓度变化曲线如图,下列说法正确的是( )
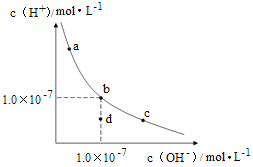
A.升高温度,可能引起由c向b的变化
B.该温度下,水的离子积常数为1.0×10-13
C.该温度下,加入FeCl3可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示,请回答:
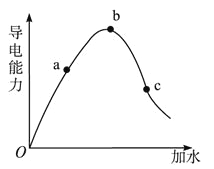
(1)“O”点导电能力为0的理由是___________________ ;
(2)a、b、c三点溶液的pH由小到大的顺序为___;
(3)a、b、c三点溶液中CH3COO物质的量最大的是___;
(4)若使c点溶液中c(CH3COO)增大,溶液的pH也增大,可采取得措施是(写出两种方法):__________________、_________________________________
(5)现有pH均为3的醋酸、硫酸两瓶溶液:
a.设两种溶液的物质的量浓度依次为c1、c2,则其关系式 ___________(用<,>,= 表示,下同)
b.取相同体积的两种酸分别加入等体积的蒸馏水后,再分别加入等量的锌粉,反应开始时放出氢气的速率依次为v1、v2,则其关系式_______________________
查看答案和解析>>
科目: 来源: 题型:
【题目】在容积为2 L的3个密闭容器中发生反应3A(g)+B(g)![]() xC(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
xC(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 3 mol A、2 mol B | 6 mol A、4 mol B | 2 mol C |
到达平衡的时间/min | 5 | 8 | |
A的浓度/(mol·L-1) | c1 | c2 | |
C的体积分数 | w1 | w3 | |
混合气体密度/(g·L-1) | ρ1 | ρ2 |
下列说法正确的是 ( )
A. 若x<4,则2c1<c2 B. 若w3=w1,可断定x=4
C. 无论x的值是多少,均有2ρ1=ρ2 D. 容器甲中反应从开始到达平衡平均速率为v(A)=0.3 mol·L-1·min-1
查看答案和解析>>
科目: 来源: 题型:
【题目】现有铁片 NaNO3晶体 NH3·H2O ④Ba(OH)2溶液 ⑤酒精 ⑥SO2六种物质,根据其有关性质,完成下列填空。
(1)属于强电解质的是___,(用序号填写,下同)
(2)属于弱电解质的是___,
(3)属于非电解质的是___,
(4)能导电的是___.
(5)关于pH=12的Ba(OH)2溶液:
a.Ba(OH)2的物质的量浓度为___ molL1
b.取此溶液10mL,稀释到1L,溶液pH= ___
c..取此溶液10mL,加入___mLpH=3的盐酸溶液,使混合液呈中性。(体积变化忽略不计)
d.把此溶液加热至95℃,pH= ___ (已知95℃,Kw=1×10-12)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com