
科目: 来源: 题型:
【题目】高铁酸钾是绿色、环保型水处理剂,也是高能电池的电极材料。工业上利用硫酸亚铁为原料,通过铁黄(FeOOH)制备高铁酸钾,可降低生产成本且产品质量优。工艺流程如下:
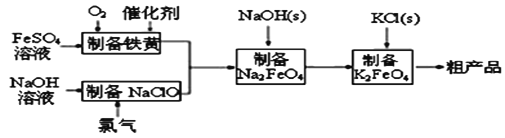
回答下列问题:
(1)有同学认为上述流程可以与氯碱工业联合。写出电解饱和食盐水制取次氯酸钠的化学方程式______________。
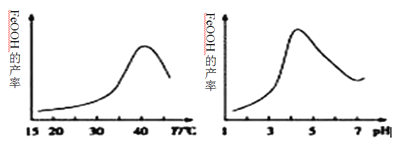
(2)制备铁黄的离子方程式为_______________。实验测得反应溶液的pH、温度对铁黄产率的影响如图所示。反应温度宜选择_________;pH大于4.5时铁黄产率逐渐降低的主要原因可能是_______________。
(3)用高铁酸钾作水处理剂除了可以对水体进行杀菌消毒之外,其还原产物氢氧化铁胶体还能吸附水中悬浮杂质,请写出用高铁酸钾除去水体中CN﹣的离子方程式______。
(4)已知:常温下,Ksp[Fe(OH)3]=4.0×10﹣38。高铁酸钾的净水能力与废水的pH有关,当溶液pH=2时,废水中c(Fe3+)=_________molL﹣1。
(5)如果上述流程中,铁元素总利用率为75%。利用1L 2molL﹣1FeSO4溶液能制备纯度为90%的高铁酸钾________g。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)已知某烷烃的键线式为![]() ,
,
①该烷烃分子式为_____。
②若该烷烃是由烯烃和 1molH2加成得到的,则原烯烃的结构有_____种。
③该烷烃在光照条件下与氯气反应,生成的一氯代烷最多有______种。(此小题不包括立体异构)
(2)沧州铁狮酒的主要成分是我们学习的有机物——乙醇,请写出该有机物官能团的名称______,该官能团的电子式______。我们还学习了与乙醇结构相似的一系列有机物如:
A.CH3OH B.(CH3)3CCH2OH C.(CH3)3COH D.(CH3)2CHOH等有机物(填字母)
①能氧化成醛的是_______ ②不能发生消去反应形成烯的是_________③能氧化成酮的是_____
查看答案和解析>>
科目: 来源: 题型:
【题目】2017 年世界地球日的主题是“节约集约利用资源,倡导绿色简约生活”。下列措施不符合这一主题的是
A. 推广使用一次性筷子,减少疾病传染
B. 使用自行车出行
C. 垃圾资源化
D. 回收旧书报
查看答案和解析>>
科目: 来源: 题型:
【题目】下图中A~J均为有机化合物,根据图中的信息,回答下列问题:
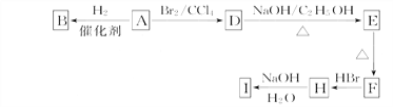
(1)环状化合物A的相对分子质量为82,含碳87.80%,含氢12.20%。B的一氯代物仅有一种,B的结构简式为__________________;
(2)M是B的一种同分异构体,M能使溴的四氯化碳溶液褪色,分子中所有的碳原子共平面,则M的结构简式为______________________;
(3)由A生成D的反应类型是________,由D生成E的反应类型是________;
由D反应生成E的化学方程式为_____________________________________;
(4)分子中含有两个碳碳双键,且两个双键之间有一个碳碳单键的烯烃与单烯烃可发生如下反应:
![]() ,则由E和A反应生成F的化学方程式为_________________;
,则由E和A反应生成F的化学方程式为_________________;
(5)H中含有的官能团是_____________(填名称,下同),I中含有的官能团是_____________。
查看答案和解析>>
科目: 来源: 题型:
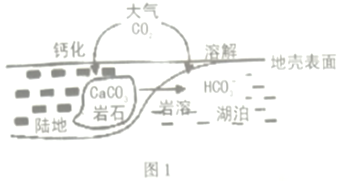
【题目】碳及其化合物广泛存在于自然界中,试回答下列问题:
(1)某处碳循环如图所示,CaCO3转化为HCO3-的离子方程式为_____________。
(2)常温常压下,空气中的CO2溶于水,达到平衡时,无机碳在浓液中以4种形式存在,其转化关系如下:
①CO2(g)+H2O![]() H2CO3 K=10-2.8
H2CO3 K=10-2.8
②H2CO3![]() H++HCO3- K1=10-3.5,
H++HCO3- K1=10-3.5,
③HCO3-![]() H++CO32- K2=10-10.3,
H++CO32- K2=10-10.3,
若溶液中。c(CO2)=1.0×10-5mol/L,且忽略水的电离及H2CO3的第二级电离,则溶液pH=_____。
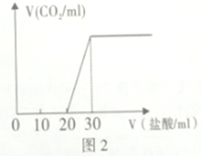
(3)某化学小组为了测量湖水中无机碳的含量,量取 100mL湖水,酸化后用N2吹出CO2,再用NaOH溶液吸收,将吸收液用0.10mol/L盐酸滴定,生成的V(CO2)随V (盐酸)变化关系如图2所示,则吸收液中离子浓度由大到小的顺序为______________(不用写出H+),湖水中无机碳的浓度为_______mol/L。
(4)—定条件下,CO2和H2O可以转化为CO和H2,通过反应:CO(g)+2H2(g) ![]() CH3OH(g)制备甲醇,若起始时在密闭容器中按物质的量之比1:2充入CO和H2,测得平衡时CO转化率a (CO)随T、P的变化关系如图3所示。
CH3OH(g)制备甲醇,若起始时在密闭容器中按物质的量之比1:2充入CO和H2,测得平衡时CO转化率a (CO)随T、P的变化关系如图3所示。
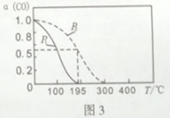
①P1__P2(填“大于”、“小于”或“等于”);
②该反应在195℃、P2条件下达到平衡后,c(H2)=0.5 mol/L ,则该反应的平衡常数为______。
③已知CH3OH和CO的燃烧热分别725.8kJ/mol、283.0 kJ/mol,1mol液态水变成气态水吸热44.0kJ,写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式:_________________。
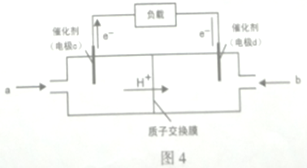
(5)用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图4,则c电极的反应方程式为:_______________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】在Na2SO4、NaCl、NaOH的混合溶液中,含有Na+、SO42-、OH-的个数比是8∶1∶2,则溶液中Na2SO4、NaCl、NaOH的物质的量之比是
A.1∶1∶1 B.1∶4∶2 C.1∶2∶4 D.1∶3∶2
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)化学反应N2(g)+![]() H2(g)
H2(g)![]() NH3(l)的能量变化如图所示,
NH3(l)的能量变化如图所示,
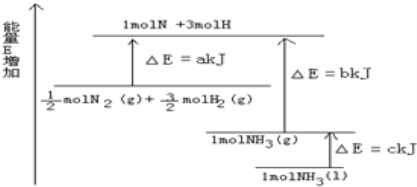
该反应放出的热量为____________________(用代数式表示)
(2)漂白剂亚氯酸钠(NaClO2)在常温下、黑暗处可保存一年。亚氯酸不稳定可分解,反应的离子方程式为HClO2―→ClO2↑+H++Cl-+H2O(未配平)。在该反应中,当有1 mol ClO2生成时转移的电子数为____________。
(3)铅蓄电池是最早使用的充电电池,由Pb、PbO2、稀硫酸构成,该电池工作时,(工作原理:Pb+PbO2+2H2SO4===2PbSO4+2H2O),若电路中转移2mol电子,则负极材料质量的变化量为_________g.
(4)一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:该反应中X的平衡转化率为__________
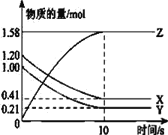
查看答案和解析>>
科目: 来源: 题型:
【题目】有两种有机物Q(![]() )与P(
)与P(![]() ),下列有关它们的说法中正确的是( )
),下列有关它们的说法中正确的是( )
A. 二者的核磁共振氢谱中均只出现两种峰且峰面积之比为3∶2
B. 二者在NaOH醇溶液中均可发生消去反应
C. 一定条件下,二者在NaOH溶液中均可发生取代反应
D. Q的一氯代物只有1种、P的一溴代物有2种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com