
科目: 来源: 题型:
【题目】下列说正确的是( )
A.物质的量就是1摩尔物质的质量
B.1 mol水中含有2 mol氢和1 mol氧
C.1 molH2中含有6.02个氢分子
D.CO2的摩尔质量是44 g/mol
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是______________。若电解电路中通过2mol电子,MnO2的理论产量为______ 克。
(2)高铁酸钠生产方法之一是电解法,其原理为Fe+2NaOH+2H2O![]() Na2FeO4+3H2↑,则电解时阳极的电极反应式是_____________________。
Na2FeO4+3H2↑,则电解时阳极的电极反应式是_____________________。
(3)用惰性电极电解100ml4mol/L的Cu(NO3)2溶液,一段时间后在阳极收集到标况下气体1.12L,
停止电解,向电解后的溶液中加入足量的铁粉,充分作用后溶液中Fe2+浓度为(设溶液体积不
变)_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】胶体区别于其他分散系的本质特征是( )
A. 胶体能产生丁达尔现象 B. 胶体是纯净物,其他分散系是混合物
C. 胶体的分散质能透过滤纸 D. 胶体的分散质粒子直径在1~100nm之间
查看答案和解析>>
科目: 来源: 题型:
【题目】元素性质呈周期性变化的根本原因是( )
A. 元素质量数的递增 B. 元素的原子半径呈周期性变化
C. 金属性和非金属性呈周期性变化 D. 原子核外电子排布呈周期性变化
查看答案和解析>>
科目: 来源: 题型:
【题目】氧族元素是指位于元素周期表第16列的元素,包括氧、硫、硒(Se)、碲(Te)、钋(Po)五种元素。
请回答下列问题:
(1)①与氧同周期的相邻元素及氧的第一电离能由大到小的顺序为________________。
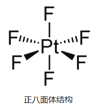
②已知:离子型配位化合物O2[PtF6]中铂元素为+ 5价,它可由反应PtF6+O2= O2[PtF6]制得,PtF6分子结构如图所示。PtF6分子中Pt的杂化轨道类型是否为sp3?答:_____(填“是”或“否”),其原因是_______。
(2)臭鼬排放的臭气主要成分为3-MBT(3-甲基-2-丁烯硫醇,结构简式为![]() )。1mol3-MBT中含有σ键数目为_______(NA为阿伏伽德罗常数的值)。沸点:3-MBT____(CH3)2C=CHCH2OH(填“高于”或“低于”),主要原因是_______________________。
)。1mol3-MBT中含有σ键数目为_______(NA为阿伏伽德罗常数的值)。沸点:3-MBT____(CH3)2C=CHCH2OH(填“高于”或“低于”),主要原因是_______________________。
(3)S有+4和+6两种价态的氧化物。
①下列关于气态SO3和SO2的说法中正确的是_____(填字母)。
A.中心原子的价层电子对数目相等
B.都是极性分子
C.中心原子的孤对电子数目相等
D.都含有极性键
②SO3子的空间构型为________,与其互为等电子体的阴离子为_____(举一例)。
(4)元素X与硒同周期,且该周期中X元素原子核外未成对电子数最多,则X为____基态原子的电子排布式为_______。
(5)单质钋是由_____键形成的晶体,其晶胞为简单立方;若已知Po的摩尔质量为Mg·mol-1,原子半径为rpm,阿伏伽德罗常数的值为NA,则钋晶体的密度的表达式为_____g·cm-3(只列表达式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮的氧化物处理和利用是环境科学研究的热点。
Ⅰ.碱吸法。用烧碱溶液吸收NO、NO2制备亚硝酸盐:2NaOH+NO2+NO=2NaNO2+H2O,2NO2+2NaOH= NaNO3+NaNO2+H2O。已知:298K时,Ka(HNO2)=5×10-4。
(1)298K时,NaNO2的水解常数约为______________。
Ⅱ.电解法。工业上以石墨为电极,用硝酸铵稀溶液作电解质溶液电解NO获得氮肥(在电解后溶液中通入适量氨气),其原理为8NO+7H2O+2NH3![]() 5NH4NO3。
5NH4NO3。
(2)阴极的电极反应式为_______________。
(3)阳极区电解质溶液的pH________(填“增大”“减小”或“不变”)。
Ⅲ.化合法。亚硝酸酰氯(NOCl)是有机合成中的重要试剂,可用NO和Cl2反应得到,化学方程式为2NO(g)+Cl2(g)![]() 2NOCl(g)。
2NOCl(g)。
(4)氮氧化物与悬浮大气中的海盐粒子相互作用会生成NOCl,涉及的相关反应有:
热化学方程式 | 平衡常数 | |
① | 2NO2(g)+NaCl(s) | K1 |
② | 4NO2(g)+2NaCl(s) | K2 |
③ | 2NO(g)+Cl2(g) | K3 |
△H1、△H2、△H3之间的关系为_____________;K3=________(用含K1、K2的关系式表示)。
(5)在2L恒容容器中充入4molNO(g)和2molCl2(g),在不同温度下测得c(NOCl)与时间(t)的关系如图所示。
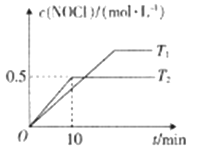
①T2时反应0~10min内NOCl的平均反应速率v(NOCl)=______mol·L-1·min-1。
②T2时反应的平衡常数K为__________;NO的平衡转化率α(NO)为_________。
③T2时向上述平衡体系中再加入1molNO(g)、1molCl2(g)、2molNOCl(g),则平衡______(填“向左”“向右”或“不”)移动。
(6)在密闭容器中充入NO(g)和Cl2(g),改变外界条件,Cl2的转化率变化如图所示。则该条件可能为____(填字母)。
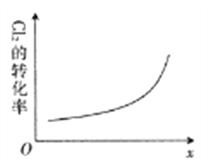
A.升高温度 B.增大压强 C.增大起始投料比![]() D.增大催化剂接触面
D.增大催化剂接触面
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于甲、乙、丙、丁四种有机物说法正确的是( )

A. 甲、乙、丙、丁中加入NaOH的醇溶液共热,然后加入稀硝酸呈酸性,再滴入AgNO3溶液,均有沉淀生成
B. 甲中加入NaOH的水溶液共热,再滴入AgNO3溶液,可检验该物质中含有的卤素原子
C. 乙发生消去反应得到两种烯烃
D. 丙与NaOH的水溶液共热,反应后生成的醇能被氧化为醛
查看答案和解析>>
科目: 来源: 题型:
【题目】下列化学性质中,己烷不具备的是( )
A. 一定条件下发生分解反应 B. 能萃取溴水中的溴
C. 光照条件下与Cl2发生取代反应 D. 能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目: 来源: 题型:
【题目】下列电离方程式正确的是( )
A. Ba(OH)2=Ba2++OH- B. Al2(SO4)3=2Al3++3SO42-
C. H2SO4=H2++SO42- D. NaHCO3=Na++H++CO32-
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是
A. 摩尔是表示物质微粒数的单位
B. H2SO4的摩尔质量是98g
C. 标准状况下,1mol任何物质的体积都约为22.4L
D. 一定温度、压强下,气体体积由其分子数目的多少决定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com