
科目: 来源: 题型:
【题目】丙烯是重要的有机化工原料。某科研小组以丙烯和布洛芬为原料合成布洛芬缓释高分子药物J的流程如下:
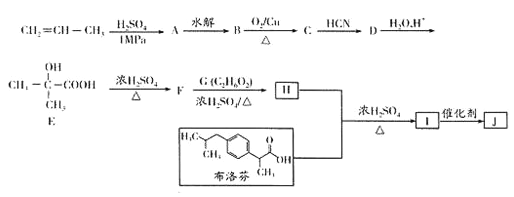
已知:①不对称结构的烯烃和H2O、H2SO4等加成时,符合如下规律:
![]()
②R-CN ![]() R-COOH(R为烃基)
R-COOH(R为烃基)
③G分子内核磁共振氢谱有两组峰,F与G按物质的量比为l:1反应生成H。
回答下列问题:
(1)CH2=CH—CH,生成A的反应类型为_________,由B生成C的化学方程式为________________
(2)由E生成F的反应类型为______________,F的化学名称是_________________。
(3)由F生成H的化学方程式为_____________。
(4)J用NaOH溶液处理,完全水解后所得产物中高分子化合物的结构简式为______________。
(5)已知:有机物K(C8H8O2)与布洛芬互为同系物,K的同分异构体中,既能发生银镜反应,又能与FeCl3溶液反应的共有________种(不含立体异构)。
(6)已知:RCH===CHCH3![]() RCH===CHCHO。以丙烯为原料(无机试剂任选),设计制备环丙醚(
RCH===CHCHO。以丙烯为原料(无机试剂任选),设计制备环丙醚(![]() )的合成路线______________。
)的合成路线______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】向K2SO4和FeCl3混合溶液中滴入Ba(OH)2溶液,当SO42-离子完全沉淀时,Fe3+也同时被完全沉淀,则原混合溶液中K2SO4和FeCl3的物质的量浓度之比为( )
A. 1:1 B. 2:1 C. 3:1 D. 3:2
查看答案和解析>>
科目: 来源: 题型:
【题目】取代反应是有机化学中一类重要的反应,下列反应属于取代反应的( )
A. 丙烷与氯气在光照条件下生成氯丙烷
B. 乙烯与溴的四氯化碳溶液反应生成1,2-二溴乙烷
C. 乙烯与水反应生成乙醇
D. 乙烯自身聚合生成聚乙烯
查看答案和解析>>
科目: 来源: 题型:
【题目】消除氮氧化物、二氧化硫等物质造成的污染是目前研究的重要课题。
(1)工业上常用活性炭还原一氧化氮,其反应为:2NO(g)+C(s) ![]() N2(g)+CO2(g)。向容积均为1 L的甲、乙、丙三个恒容恒温容器中分别加入足量的活性炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g)。向容积均为1 L的甲、乙、丙三个恒容恒温容器中分别加入足量的活性炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
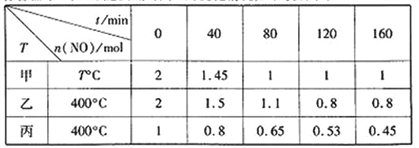
甲容器反应温度T℃______400℃(填“>”“<”或“=”);乙容器中,0~40min内平均反应速率v(CO2)=_____;丙容器中达平衡后NO的物质的量为_________mol。
(2)活性炭还原NO2的反应为:2NO2(g)+2C(s) ![]() N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量活性炭发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如右上图所示:
N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量活性炭发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如右上图所示:
①A、B、C三点中NO2的转化率最高的是_________点(填“A”或“B”或“C”)。
②计算C点时该反应的压强平衡常数KP=_______MPa
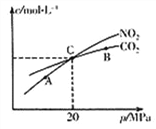 (Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)燃煤烟气脱硫常用如下方法。
方法①:用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫。涉及的部分反应如下:
2CO(g)+SO2(g)=S(g)+2CO2(g) △H1=8.0 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H2=-566.0kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H3=-483.6 1kJ·mol-1
则H2(g)还原SO2(g)生成S(g)和H2O(g)的热化学方程式为_______________________。
方法②:用氨水将SO2转化为NH4HSO3,再氧化成(NH4)2SO4。
实验测得NH4HSO3溶液中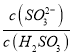 =15,则溶液的pH为________;向该溶液中加氨水使溶液呈中性时,
=15,则溶液的pH为________;向该溶液中加氨水使溶液呈中性时, 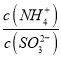 =________。(已知:H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)
=________。(已知:H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验操作能达到实验目的是( )
A.用排水法收集铜粉与浓硝酸反应产生的NO2
B.用氨水鉴别NaCl、MgCl2、AlCl3、NH4Cl四种溶液
C.用酸性KMnO4溶液验证草酸的还原性
D.用饱和NaHCO3溶液除去Cl2中混有的HCl
查看答案和解析>>
科目: 来源: 题型:
【题目】当前材料科学的发展方兴未艾。B、N、Ti、Cu、Zn都是重要的材料元素,其单质和化合物在诸多领域都有广泛的应用。
(1)单晶硅太阳能电池片加工时一般掺杂微量的铜,二价铜离子的价电子排布式为_____________。在高温条件下Cu2O比CuO更稳定,试从铜原子核外电子结构变化角度解释__________________。
(2)BF3分子与NH3分子的空间构型为__________、___________,BF3与NH3反应生成的BF3·NH3分子中含有的化学键类型为_________________。
(3)金属Ti的性能优越,能与B、C、N、O等非金属元素形成稳定的化合物。电负性:C_____B(填“>”或“<”,下同),第一电离能:N_______O。
(4)月球岩石——玄武岩的主要成分为钛酸亚铁(FeTiO3),钛酸亚铁与浓硫酸反应生成TiSO4,SO42-中S原子的杂化方式为________,用价层电子对互斥理论解释SO32-的键角比SO42-键角小的原因__________________。
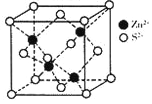
(5)ZnS在荧光体、涂料等行业中应用广泛。立方ZnS晶体结构如图所示,其晶胞边长为a cm,密度为__________g·cm-3
查看答案和解析>>
科目: 来源: 题型:
【题目】海洋中蕴含着丰富的资源。利用海水提取淡水、溴和镁的部分过程如图所示。
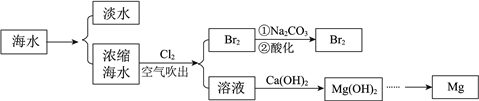
(1)海水淡化的方法有___________、离子交换法和电渗析法等。
(2)用纯碱吸收浓缩海水吹出的Br2:3Br2+ 6Na2CO3+3H2O=5NaBr+NaBrO3+6NaHCO3。若吸收3 mol Br2时,转移的电子是________ mol。
(3)海水中部分离子的含量如下:
成分 | 含量(mg/L) | 成分 | 含量(mg/L) |
Na+ | 10560 | Cl- | 18980 |
Mg2+ | 1272 | Br- | 64 |
Ca2+ | 400 | SO42- | 2560 |
其中,Mg2+的物质的量浓度是_____________ mol/L。若从100 L的海水中提取镁,理论上加入沉淀剂Ca(OH)2的质量是____________ g。
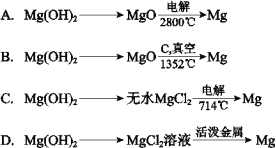
(4)由Mg(OH)2得到单质Mg,以下方法最合适的是__________(填序号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com