
科目: 来源: 题型:
【题目】下列说法正确的是
A.按系统命名法,![]() 的名称为2,7,7-三甲基-3-乙基辛烷
的名称为2,7,7-三甲基-3-乙基辛烷
B.实验证实![]() 可使Br2/CCl4溶液褪色,说明该分子中存在独立的碳碳单键和碳碳双键
可使Br2/CCl4溶液褪色,说明该分子中存在独立的碳碳单键和碳碳双键
C. DDT的结构简式为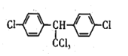 ,分子中最多有14个碳原子共平面
,分子中最多有14个碳原子共平面
D. 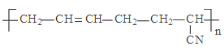 的单体是CH3-C≡C-CH3和CH2=CH-CN
的单体是CH3-C≡C-CH3和CH2=CH-CN
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是()
A. 不含其他杂质的天然油脂属于纯净物
B. 肥皂的有效成分为硬脂酸钠和甘油
C. 油脂的烃基部分饱和程度越大,熔点越低
D. 各种油脂水解后的产物中都有甘油
查看答案和解析>>
科目: 来源: 题型:
【题目】将质量均为100g的锌片和铜片用导线与灯泡串联浸入盛有500mL 2 mol·L-1稀硫酸溶液的1.5L容器中构成如下装置。
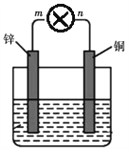
(1)该装置中发生反应总的离子方程式为________________,溶液中______(填微粒化学式)向锌极移动。
(2)若2 min后测得锌片质量减少13g,则导线中流过的电子为__________mo1,电子的流动方向____________(用m、n表示)。若将正极生成的气体不断导入一个2L的刚性容器中,则反应开始至2min用该气体表示的反应速率为_______________。
(3)当反应进行到3min 时灯泡亮度较弱,某同学向该装置内溶液中加入__________(填序号)灯泡的亮度会突然增加。
a.300mL蒸馏水 b.100mL 8 mol·L-1硫酸溶液
c.300mL 10 mol·L-1硫酸铜溶液 d.200mL 8 mol·L-1氢氧化钠溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】某一化学反应,反应物和生成物都是气体,改变下列条件一定能使化学平衡向正反应方向移动的是( )
A.增大反应物浓度 B.减小反应容器的体积
C.增大生成物浓度 D.升高反应温度
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A.分子式为C10H12O2的有机物,①苯环上有两个取代基,②能与NaHCO3反应生成气体,满足以上2个条件的该有机物的同分异构体有15种
B.对苯二甲酸(![]() )与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚酯纤维
)与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚酯纤维
(![]() )
)
C.分子式为C5H12O的醇,能在铜催化下被O2氧化为醛的同分异构体有5种
D.![]() 分子中的所有原子有可能共平面
分子中的所有原子有可能共平面
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是
A. 常温常压下,lmoI丙烷共用电子对数为10 NA
B. 0.5 moI甲烷和0.5 mol乙酸完全燃烧消耗的O2分子数都为0.2NA
C. 标准状况下,1L辛烷充分燃烧后生成气态产物的分子数为![]()
D. 1 mol甲醇与足量钠反应,转移电子数目为2 NA
查看答案和解析>>
科目: 来源: 题型:
【题目】在下列各组离子中,能大量共存的( )
A.Ag+、NO3﹣、Na+、Cl﹣
B.K+、HCO3﹣、Cl﹣、Al3+
C.NO3﹣、Fe2+、H+、Br﹣
D.K+、Cl﹣、SO42﹣、NH4+
查看答案和解析>>
科目: 来源: 题型:
【题目】溴化钙晶体(CaBr2·2H2O)为白色固体,易溶于水,可用于制造灭火剂、制冷剂等。一种制备溴化钙晶体的工艺流程如下:
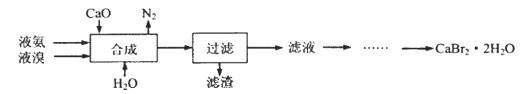
(1)实验室模拟海水提溴的过程中,用苯萃取溶液中的溴,分离溴的苯溶液与水层的操作是(装置如下图):使玻璃塞上的凹槽对准漏斗上的小孔,将活塞拧开,使下面的水层慢慢流下,待有机层和水层界面与活塞上口相切即关闭活塞,______________。
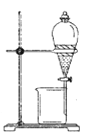
(2)“合成”的化学方程式为___________________。 “合成”温度控制在70℃以下,其原因是__________。投料时控制n(Br2):n(NH3)= 1:0.8,其目的是__________________。
(3)“滤渣”的主要成分为_________________(填化学式)。
(4)“滤液”呈强碱性,其中含有少量BrO-、BrO3-,请补充从“滤液”中提取CaBr2·2H2O的实验操作:加热驱除多余的氨,______________。[实验中须使用的试剂有:氢溴酸、活性炭、乙醇;除常用仪器外须使用的仪器有:砂芯漏斗,真空干燥箱]
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.现有硫酸和盐酸的混合溶液20mL,在该溶液中滴入0.05mol/L的Ba(OH)2溶液时,生成BaSO4的质量和溶液的pH得到如图所示的结果,求:

⑴最初混合液中硫酸的物质的量浓度____________________
盐酸的物质的量浓度____________________
⑵在A点溶液的pH=____________________。
Ⅱ.Ba2+是一种重金属离子,对生物体有害,环境监测小组欲利用Na2S2O3、KI、K2Cr2O7等试剂测定某工厂废水中Ba2+的浓度。
(1)现需配制250mL0.100mol·L—1标准Na2S2O3溶液,所需要的玻璃仪器除量筒、250mL容量瓶、玻璃棒外,还需要_____________________。
(2)需准确称取Na2S2O3固体的质量为________________g。
(3)另取废水50.00mL,控制适当的酸度加入足量的K2Cr2O7溶液,得BaCrO4沉淀;沉淀经洗涤、过滤后,用适量的稀盐酸溶解,此时CrO42-全部转化为Cr2O72-;再加过量KI溶液反应,反应液中再滴加上述Na2S2O3溶液,反应完全时,消耗Na2S2O3溶液36.00mL。
已知有关的离子方程式为:
①Cr2O72-+6I-+14H+ 2Cr3++3I2+7H2O;
②I2+2S2O32- 2I-+S4O62-.试计算该工厂废水中Ba2+的物质的量浓度c(Ba2+)=________________________。
Ⅲ.试回答下列问题:
(1)已知24 g A和40 g B恰好完全反应生成0.4 mol C和32 g D,则C的摩尔质量为_________________。
(2)把1 mol Na和1 mol Mg分别投入到等量且过量的盐酸中,分别得到溶液a和b,则溶液a和b的质量关系为ma_____________mb。
(3)如图为实验室某浓盐酸试剂瓶的标签上的有关数据,试根据标签上的有关数据回答下列问题:
盐酸
分子式:HCl
相对分子质量:36.5
密度:1.19 g·cm-3
HCl的质量分数:36.5%
①该浓盐酸中HCl的物质的量浓度为____________mol·L-1。
②标准状况下,1.00 L水(密度为1.00 g·cm-3)吸收_____________L的HCl可制得上述浓盐酸(保留整数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于氯气的叙述中,正确的是( )
A. 氯气以液态形式存在时可称为氯水或液氯 B. 红热的铜丝在氯气中燃烧,冒蓝色烟
C. 有氯气参加的化学反应必须在溶液中进行 D. 钠在氯气中燃烧生成白色固体氯化钠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com