
科目: 来源: 题型:
【题目】氢气是清洁的能源,也是重要的化工原料。
(1)以H2为原料制取氨气进而合成CO(NH2)2的反应如下:
N2(g)+3H2(g)+CO2(g)===CO(NH2)2(s)+H2O(l) ΔH=179.38 kJ·mol1
已知: 2NH3(g)+CO2(g)===NH2CO2NH4(s) ΔH=159.47 kJ·mol1
NH2CO2NH4(s) ===CO(NH2)2(s)+H2O(l) ΔH=+72.49 kJ·mol1
则N2(g)+3H2(g) ===2NH3(g) ΔH= kJ·mol1。
(2)储氢材料领域是当前研究热点,LiBH4是一种良好的储氢材料。采用球磨法制备Al与LiBH4的复合材料,并对AlLiBH4体系与水反应产氢的特性进行下列研究:
①图甲为25℃水浴时每克不同配比的AlLiBH4复合材料与水反应产生H2体积随时间变化关系图。由图可知,下列说法正确的 (填字母)。

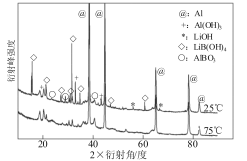
甲 乙
a.25℃时,纯LiBH4和铝均与水反应产生氢气
b.25℃时,复合材料中铝不能产生氢气,只是起到催化作用
c.25℃时,AlLiBH4复合材料中LiBH4含量25%,储氢效果最好
②图乙为25℃和75℃时,AlLiBH4复合材料[ω(LiBH4)=25%]与水反应一定时间后产物的X射线衍射图谱(X射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。从图分析,25℃时AlLiBH4复合材料中LiBH4与水反应生成的LiB(OH)4化学方程式为 ,铝元素的存在有多种形式,其中Al(OH)3产生的原因可能是 。
(3)已知H2S高温热分解制H2的反应为:H2S(g)![]() H2(g)+1/2S2(g)在恒容密闭容器中,控制不同温度进行H2S的分解实验,以H2S的起始浓度均为c mol·L1测定H2S的转化率,结果如下图所示:
H2(g)+1/2S2(g)在恒容密闭容器中,控制不同温度进行H2S的分解实验,以H2S的起始浓度均为c mol·L1测定H2S的转化率,结果如下图所示:

图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。若985℃时,反应经t min达到平衡,此时H2S的转化率为40%,则反应速率v(S2)= (用含c、t的代数式表示)。请说明随温度的升高,曲线b向曲线a逼近的原因: 。
(4)用惰性电极电解煤浆液的方法制H2的反应为:C(s)+2H2O(l) ===CO2(g)+2H2(g)现将一定量的1 mol·L1 H2SO4溶液和适量煤粉充分混合,制成含碳量为0.02 g·mL1~0.12g·mL1的煤浆液,置于如图所示装置中进行电解(两电极均为惰性电极)。则B极的电极反应式为 。

查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,将气体A和气体B各0.16mol充入2 L恒容密闭容器中,发生反应:A(g)+B(g)![]() 2C(g) ΔH<0。一段时间后达到平衡,反应过程中测定的数据如下表:
2C(g) ΔH<0。一段时间后达到平衡,反应过程中测定的数据如下表:
t/min | 2 | 4 | 6 | 8 |
n(B)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A.反应前2 min的平均速率ν(C) = 0.04 mol·L1·min1
B.其他条件不变,升高温度,反应达到新平衡前ν(逆)>ν(正)
C.其他条件不变,向平衡体系中再充入0.32 mol 气体C,到达平衡时,n(C)<0.24 mol
D.其他条件不变,向平衡体系中通入A、B、C各0.1 mol气体,气体B的转化率不变
查看答案和解析>>
科目: 来源: 题型:
【题目】甲烷在空气中燃烧生成二氧化碳和水,同时产生淡蓝色火焰,下列说法正确的是
A. 形成H-O键吸收能量 B. 该反应是吸热反应
C. 断裂C-H键放出热量 D. 该反应是放热反应
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于价层电子对互斥模型(VSEPR模型)的叙述中不正确的是 ( )
A. VSEPR模型可用来预测分子的立体结构
B. 分子中价电子对相互排斥决定了分子的空间结构
C. 中心原子上的孤电子对不参与互相排斥
D. 分子中键角越大,价电子对相互排斥力越小,分子越稳定
查看答案和解析>>
科目: 来源: 题型:
【题目】在2L密闭容器内,800℃时反应:2NO(g)+O2(g)![]() 2NO2(g)体系中,c(NO)随时间的变化如表:
2NO2(g)体系中,c(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)(mol/L) | 0.10 | 0.05 | 0.04 | 0.03 | 0.03 | 0.03 |
(1)分析上表,该反应达到平衡状态所需时间是_________。
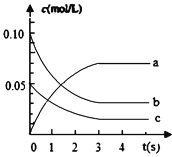
(2)上图中表示NO2的浓度变化曲线是_______________。
(3)用NO表示从0~2s内该反应的平均速率v=________。
(4)v(NO):v(O2) = ______________。
(5)达到平衡状态时O2的转化率为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上曾经通过反应“3Fe+4NaOH![]() Fe3O4+2H2↑+4Na↑”生产金属钠。下列有关说法正确的是
Fe3O4+2H2↑+4Na↑”生产金属钠。下列有关说法正确的是
A.1100 ℃时铁与NaOH溶液反应
B.该反应条件下铁的氧化性比钠强
C.生成的气体可以在真空中冷却获得金属钠
D.每生成1 mol Fe3O4,转移的电子数约为4×6.02×1023
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验中,能证明苯酚的酸性极弱的是 ( )
A. 苯酚的水溶液中加入氢氧化钠溶液,生成苯酚钠
B. 苯酚在空气中容易被氧化为粉红色
C. 苯酚钠溶液中通入二氧化碳后,溶液由澄清变浑浊
D. 浑浊的苯酚溶液加热变澄清
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
选项 | 实验 | 解释或结论 |
A | 向溶液X中滴加盐酸无明显现象,再滴加BaCl2溶液有白色沉淀生成 | X中含有 |
B | 用洁净的玻璃管向包有Na2O2的脱脂棉吹气,脱脂棉燃烧 | CO2、H2O与Na2O2反应是放热反应 |
C | 向1 mL 1% NaOH溶液加入2 mL 2%的CuSO4溶液,振荡后滴加0.5 mL5%葡萄糖溶液,加热未出现红色沉淀 | 葡萄糖中不含醛基 |
D | 将硫酸酸化的H2O2滴入Fe(NO3)2溶液,溶液变黄色 | H2O2的氧化性比Fe3+强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com