
科目: 来源: 题型:
【题目】在2NO2![]() N2O4的可逆反应中,下列状态一定属于平衡状态的是( )
N2O4的可逆反应中,下列状态一定属于平衡状态的是( )
A. N2O4和NO2的分子数比为1:2
B. N2O4和NO2的浓度相等
C. 体系的颜色不再改变
D. 单位时间内有1molN2O4转化为NO2的同时,有2molNO2转化为N2O4
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. 淀粉与纤维素的相对分子质量相等
B. 用灼烧的方法鉴别蚕丝和人造纤维
C. 蛋白质中加入浓硝酸一定显黄色
D. 淀粉、氨基酸和油脂均能发生水解反应
查看答案和解析>>
科目: 来源: 题型:
【题目】环境污染影响人类生存,治理污染是化学工作者研究的重要课题。
Ⅰ.汽车尾气主要成分有CO、SO2、氮氧化物等,科学家目前正尝试用二氧化钛(TiO2)催化分解汽车尾气。
(1)已知:2NO(g)+O2==2NO2(g) ΔH1=113.0 kJmol1
2SO2(g)+O2(g)==2SO3(l) ΔH2=288.4 kJmol1
请判断反应NO2(g)+SO2(g)==NO(g)+SO3 (l),在低温下能否自发进行,并说明理由 。
(2)已知TiO2催化汽车尾气降解的原理为:
2CO(g)+O2(g)![]() 2CO2(g);4NO(g)+3O2(g)+2H2O(g)
2CO2(g);4NO(g)+3O2(g)+2H2O(g)![]() 4HNO3(g)。
4HNO3(g)。
①在O2浓度几乎不变的条件下,模拟CO、NO的降解,得到降解率随时间变化如图1所示。反应40秒后检测到混合气体中N2浓度明显上升而HNO3(g)浓度有所降低,请用化学方程式并结合化学反应原理解释出现该现象的可能原因 。

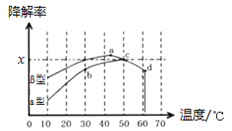
②图2为在不同颗粒间隙的沥青混凝土(α、β型)和不同温度下,实验进行相同一段时间(t秒)后测得的CO降解率变化。已知50℃、t秒时容器中O2浓度为0.01 molL1,求此温度下在α型沥青混凝土中CO降解反应的平衡常数 。
③下列关于图2 的说法不正确的是 。
A.根据降解率由b到c随温度的升高而增大,可知CO降解反应的平衡常数Kb<Kc
B.相同温度下β型沥青混凝土中CO降解速率比α型要大
C.a点的数据反映出CO与O2之间所发生的有效碰撞频率是整个实验过程中最高的
D.d点降解率出现突变的原因可能是温度升高后催化剂失效
Ⅱ.对燃煤烟气的脱硫、脱硝处理是环境科学研究的热点。
(3)工业上采用尿素[CO(NH2)2]湿法进行脱硫和脱硝,其过程表示如下:

①上述过程中脱硫反应的化学方程式为 。
②尿素溶液中存在如下反应:CO(NH2)2(aq)+H2O![]() NH2COONH4(aq) (ΔH<0),研究表明,增大溶液中NH2COONH4的浓度会使脱硫速率明显加快,因此工业生产中常将温度控制在60℃左右,原因是:温度过低,该反应进行很慢,使溶液中NH2COONH4的含量较少; (请将原因补充完整)。
NH2COONH4(aq) (ΔH<0),研究表明,增大溶液中NH2COONH4的浓度会使脱硫速率明显加快,因此工业生产中常将温度控制在60℃左右,原因是:温度过低,该反应进行很慢,使溶液中NH2COONH4的含量较少; (请将原因补充完整)。
③工业上常用NaOH溶液吸收法脱硝,化学方程式为:NO+NO2+2NaOH==2NaNO2+H2O,2NO2+2NaOH=NaNO2+NaNO3+H2O,现有平均组成为NOx的NO、NO2混合气体,通入足量的NaOH溶液中,充分反应后没有气体剩余,则x的取值范围为 ;反应后溶液中n(NO2)︰n(NO3)= (用含x的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
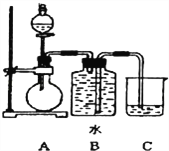
【题目】如图装置可以用来制取某些气体.
(1)该装置可以制备乙炔气体,圆底烧瓶中盛放的物质是__________(填电子式)分液漏斗中盛放的是______,目的是______________________________________.
(2)实验室中制备乙炔的反应原理是______________________________________.
(3)用此方法制取的乙炔气体通常混有H2S气体,如何除去?____(填化学试剂)
(4)还能用该装置制备和收集的气体有(答出任意一种即可)______________.
(5)若用来制备乙烯气体,需要对装置进行改进,将分液漏斗改成温度计,温度计的水银球放置的位置是_________,改进时还需要的玻璃仪器是_____________.
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关铁及其化合物的说法中不正确的是( )
A. 工业上在高温下用CO还原含Fe2O3的铁矿石炼铁
B. 铁在纯氧中燃烧或高温下和水蒸气反应均能得到Fe3O4
C. 工业上可用铁质容器储存、运输浓硝酸和浓硫酸
D. 氯化铁溶液有较强氧化性,故可用作净水剂
查看答案和解析>>
科目: 来源: 题型:
【题目】下列制备金属单质的方法或原理正确的是 ( )。
A. 在高温条件下,用H2还原MgO制备单质Mg
B. 在通电条件下,电解熔融Al2O3制备单质Al
C. 在通电条件下,电解饱和食盐水制备单质Na
D. 加强热,使CuO在高温条件下分解制备单质Cu
查看答案和解析>>
科目: 来源: 题型:
【题目】以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)为原料,制备粗铅,可以实现铅的再生利用。其工艺流程如图1所示:
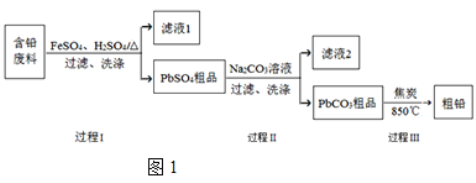
已知:Ksp(PbSO4)=1.6×105,Ksp(PbCO3)=3.3×1014。
(1)过程Ⅰ中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是 。
(2)过程Ⅰ中,Fe2+ 催化过程可表示为:
ⅰ.2Fe2++PbO2+4H++SO42==2Fe3++PbSO4+2H2O
ⅱ.……
①写出ⅱ的离子方程式 。
②下列实验方案可证实上述催化过程,将实验方案补充完整。
a.向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2,溶液变红;b. 。
(3)过程Ⅱ的目的是脱硫。若滤液2中c(SO42)=1.6 molL1,c(CO32)=0.1 molL1,则PbCO3中____ (填“是”或“否”)混有PbSO4。
(4)为测定粗产品的纯度,可用EDTA(简写为Y4)标准溶液滴定,反应的离子方程式为:Pb2++Y4==PbY2。测定时,先称取0.2500 g粗铅,溶于足量稀硝酸,以试剂掩蔽少量干扰离子,用0.0500 mol·L1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液23.00 mL,则粗产品中铅的含量为 (以质量分数表示)。
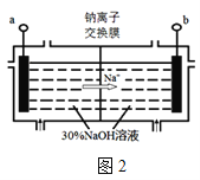
(5)钠离子交换膜固相电解法是从含铅废料中提取铅的一种新工艺,其装置如图2所示。将含铅废料投入阴极室,含铅废料中的PbSO4与NaOH溶液发生反应:PbSO4+3OH=HPbO2+SO42+H2O。
①b与外接电源的 极相连。
②电解过程中,PbO2、PbO、HPbO2在阴极放电,其中PbO2放电的电极反应式为 。
③与传统无膜固相电解法相比,使用钠离子交换膜可以提高Pb元素的利用率,原因是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质分类正确的是
A. SO2、SiO2、CO均为酸性氧化物
B. 稀豆浆、硅酸、氯化铁溶液均为胶体
C. 烧碱、冰醋酸、四氯化碳均为电解质
D. 福尔马林、水玻璃、氨水均为混合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com