
科目: 来源: 题型:
【题目】六氟化硫分子呈正八面体形(如图所示),在高电压下仍有良好的绝缘性,在电器工业方面有着广泛的用途,但逸散到空气中会引起温室效应。下列有关六氯化硫的推测正确的是
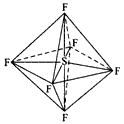
A. 六氟化硫不能燃烧
B. 六氟化硫中各原子均达到8电子稳定结构
C. 六氟化硫在水中的溶解度>六氟化硫在CS2中的溶解度
D. 六氟化硫分子是极性分子
查看答案和解析>>
科目: 来源: 题型:
【题目】用废铅蓄电池的铅泥(含PbSO4、PbO和Pb等)可制备精细化工产品3PbO·PbSO4· H 2O(三盐),主要制备流程如下。
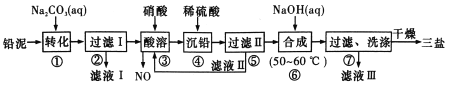
(1)铅蓄电池在生活中有广泛应用,其工作原理是Pb+PbO2+2H2SO4 ![]() 2PbSO4+2H2O。铅蓄电池在充电时,阳极的电极反应式为_________。若铅蓄电池放电前正、负极质量相等,放电时转移了lmol电子,则理论上两极质量之差为___________。
2PbSO4+2H2O。铅蓄电池在充电时,阳极的电极反应式为_________。若铅蓄电池放电前正、负极质量相等,放电时转移了lmol电子,则理论上两极质量之差为___________。
(2)将滤液I、滤液III合并,经蒸发浓缩、降温结晶、过滤等操作,可得到一种结晶水合物( Mr=322) ,其化学式为______________。
(3)步骤③酸溶时铅与硝酸反应生成Pb(NO3)2及NO的离子方程式为_____________;滤液II中溶质的主要成分为________(填化学式)。
(4)步骤⑥合成三盐的化学方程式为____________ 。
(5)步骤⑦的洗涤操作中,检验沉淀是否洗涤完全的操作方法是____________。
查看答案和解析>>
科目: 来源: 题型:
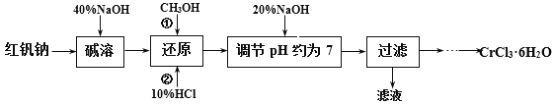
【题目】氯化铬晶体(CrCl3·6H2O)是一种重要的工业原料,工业上常用铬酸钠(Na2CrO4)来制备。实验室中以红矾钠(Na2Cr2O7)为原料制备CrCl3·6H2O的流程如下:
 已知:①Cr2O72-+H2O
已知:①Cr2O72-+H2O![]() 2CrO42-+2H+;
2CrO42-+2H+;
②CrCl3·6H2O不溶于乙醚,易溶于水、乙醇,易水解。
③甲醇,无色液体,有毒,沸点64.7,易燃。
请回答:
(1)碱溶的目的是____,所加40%NaOH不宜过量太多的原因是____。
(2)还原时先加入过量CH3OH再加入10%HCl,生成CO2,该反应的离子方程式为____。
(3)使用下列用品来测定溶液的pH,合理的是____(填字母)。
A.pH计 B.pH试纸 C.酚酞溶液
(4)使用下图装置从滤液中分离出CH3OH。
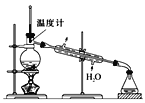
①该装置中存在的错误是____。
②在改正后的装置中,在仪器A中加入沸石,再加入滤液,蒸馏,收集蒸馏出的CH3OH循环使用。有的同学认为,该过程中需要加入CaO,防止水随CH3OH一起蒸出,你认为是否有必要并说明理由:____。
(5)请补充完整由过滤后得到的固体Cr(OH)3制备CrCl3·6H2O的实验方案:将过滤后所得固体____,____,冷却结晶,过滤,____,低温干燥,得到CrCl3·6H2O。
(实验中可供选择的试剂:盐酸、硫酸、蒸馏水、乙醇、乙醚)
查看答案和解析>>
科目: 来源: 题型:
【题目】已知草酸为二元弱酸:
H2C2O4![]() HC2O4-+H+ Ka1
HC2O4-+H+ Ka1
HC2O4-![]() C2O42-+H+ Ka2
C2O42-+H+ Ka2
常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中H2C2O4、HC2O4-、C2O42-三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是
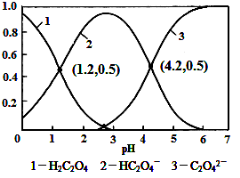
A.pH=1.2溶液中:c(K+) + c(H+) = c(OH-) + c(H2C2O4)
B.pH=2.7溶液中:c2(HC2O4-) / [c(H2C2O4) × c(C2O42-)]=1000
C.将相同物质的量KHC2O4和K2C2O4固体完全溶于水可配得pH为4.2的混合液
D.向pH=1.2的溶液中加KOH溶液将pH增大至4.2的过程中水的电离度一直增大
查看答案和解析>>
科目: 来源: 题型:
【题目】在苯的同系物中,加入少量酸性高锰酸钾溶液,振荡后溶液褪色,下列解释正确的是 ( )
A. 苯的同系物中碳原子数比苯分子中原子数多
B. 苯环被KMnO4所氧化而破坏
C. 侧链受苯环的影响而易被氧化
D. 苯环和侧链相互影响,同时被氧化
查看答案和解析>>
科目: 来源: 题型:
【题目】欧盟征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫。请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)近年来,我国储氢碳纳米管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,请完成并配平下述化学方程式:
口C+口K2Cr2O7+口______=口CO2↑+口K2SO4+口Cr2(SO4)3+口H2O
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)=CH3OH(g) △H1=-116kJ/mol
①下列措施中有利于增大该反应的反应速率的是_______(填字母代号)。
A.随时将CH30H与反应混合物分离 B.降低反应温度
C.增大体系压强 D.使用高效催化剂
②已知:CO(g)+1/2O2(g)=CO2(g) △H2=-283kJ/mol
H2(g)+1/2O2(g)=H2O(g) △H3=-242kJ/mol
则表示lmol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为______________。
③在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃ 三种温度下合成甲醇的规律。右图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为lmol)与CO平衡转化率的关系。
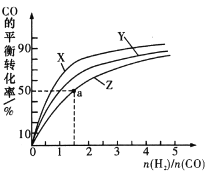
请回答:
i)在上述三种温度中,曲线Z对应的温度是_________;
ii)利用图中a点对应的数据,计算出曲线Z在对应温度下,反应CO(g)+2H2(g)=CH3OH(g)的平衡常数K=__________。
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。 CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为5.6×10-5mol/L,则生成沉淀所需CaCl2溶液的最小浓度为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】西瓜膨大剂别名氯吡苯脲,是经过国家批准的植物生长调节剂,实践证明长期使用对人体无害。已知其相关性质如下表所示:
分子式 | 结构简式 | 外观 | 熔点 | 溶解性 |
C12H10ClN3O |
| 白色结晶粉末 | 170~172°C | 易溶于水 |
(1)氯元素基态原子核外电子的成对电子数为__________,氯吡苯脲中所含元素能形成10电子分子,且分子之间能形成氢键的有__________________。(填二种,填化学式)
(2)氯吡苯脲的晶体类型为_________晶体。该分子是由______________键形成的____________分子(填“极性”或“非极性”)
查看答案和解析>>
科目: 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列有关叙述正确的是
A. 常温下,4.6gNO2和N2O4混合气体中所含原子总数为0.3NA
B. 4.2g乙烯和丙烯混合气体中含有的极性键数目为0.8NA
C. 常温下,1L0.5mol/LNH4Cl溶液与2L0.25mol/LNH4Cl溶液所含NH4+的数目相同
D. 1mol铁粉在1mol氯气中充分燃烧,转移的电子数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com