
科目: 来源: 题型:
【题目】苯酚具有重要用途,请观察如下合成路线:

(1)请结合相关信息,写出以苯酚和乙烯为原料制备有机物![]() 的合成路线流程图(无机试剂任用):_________________________________________________。
的合成路线流程图(无机试剂任用):_________________________________________________。
(2)某化合物是D的同分异构体,且分子中只有三种不同化学环境的氢。写出该化合物的结构简式:___________、___________ (任写两种)。
查看答案和解析>>
科目: 来源: 题型:
【题目】五种短周期主族元素X、Y、Z、M、R的原子半径和最外层电子数之间的关系如右图所示,其中R的原子半径是短周期主族元素原子中最大的。下列说法正确的是( )
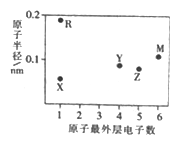
A. 元素的非金属性:X>Z>Y
B. M的单质常温常压下为气态
C. X和M形成的二元化合物的水溶液呈弱酸性
D. Y、Z、M的最高价氧化物的水化物均为强酸
查看答案和解析>>
科目: 来源: 题型:
【题目】由短周期元素组成的单质A、B、C和甲、乙、丙、丁、戊五种化合物有下图所示转换关系。A是在地壳中含量最多的金属元素。请回答:
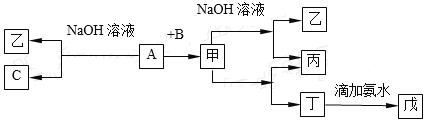
(1)物质的化学式为:乙_______,丁_______,戊________;
(2)甲物质在工业上的一种重要用途:_________________;
(3)A在元素周期表中的位置:__________________________;
(4)A→乙+C反应的化学方程式___________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】关于钯(46Pd)的说法错误的是
A. 102Pd 和 103Pd 互为同位素 B. Pd2+核外有 46 个电子
C. 钯是第五周期元素 D. 108Pd 的原子核内有 62 个中子
查看答案和解析>>
科目: 来源: 题型:
【题目】实验测得某碳氢化合物A中含碳80%,含氢20%,该化合物的实验式是__________,又测得该化合物的相对分子质量是30,该化合物的分子式______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲烷分子中的4个氢原子全部被苯基取代,可以得到如图所示的分子。下列说法中正确的是

A. 该分子的分子式为C24H20
B. 该分子中所有的碳原子都在同一平面上
C. 该分子能够发生氧化反应
D. 该分子属于有机高分子
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:A是来自石油的重要有机化工原料,E是具有果香味的有机物,F是一种高聚物,可制成食品包装材料。
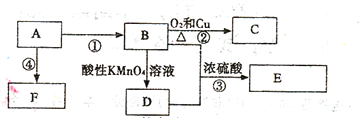
(1)依次写出A、C的结构简式为_________ __________。
(2)依次写出B、D分子中的官能团名称_________ __________。
(3)写出下列反应的化学方程式,并注明反应类型:
①______________________________________________;
②______________________________________________;
③______________________________________________;
④_______________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A是元素周期表中原子半径最小的元素;B元素最高价氧化物对应的水化物与其氢化物反应生成一种盐X; D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的3/4倍;C与E同主族。请回答下列问题:
(1)依次写出A、B、C、D、E五种元素的名称 _____ _____ _____ _____ _____ 。
(2)X的名称为_________,A、C、D构成的化合物中含有的化学键有_____________。
(3)下列各项中,能说明元素C比E非金属性强的事实有____________(填序号)。
①氢化物H2E的酸性比H2C强
②氢化物H2C的热稳定性比H2E强
③氢化物H2E的水溶液放置在空气中会变浑浊
④C与E组成化合物,C显负价
(4)将由BC和BC2组成的混合气体通入下图所示装置中,用来验证浓硝酸的氧化性比稀硝酸的氧化性强。
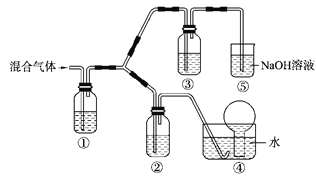
已知(ⅰ)浓硝酸能将气体BC氧化成BC2,而稀硝酸不能氧化BC。
(ⅱ)NaOH溶液与BC2反应的化学方程式为:
2NaOH+2BC2 ====== NaBC2+NaBC3+ H2O, NaOH溶液与BC气体不反应。
装置①、②、③中盛放的药品依次是_________、_________、 ___________。
(5)通入混合气体之前,应先通入一段时间某另外一种气体,试推测先通入的该气体可以是___________(填一种气体的化学式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组设计实验探究Mg与盐溶液反应的多样性。
实验 | 向试管中加2mL溶液 | 实验现象 |
| 实验I: 0.1 mol/L AgNO3溶液 | 镁条表面迅速覆盖一层疏松黑色固体,并有少量气泡产生 |
实验II: 2.0 mol/L NH4Cl溶液 | 反应开始时产生大量气体(经检验其中含有H2),一段时间后产生使湿润的红色石蕊试纸变蓝的气体 | |
实验III: pH=8.2 NaHCO3溶液 | 产生大量气体(经检验其中含有H2和CO2)和白色固体 |
请回答下列问题:
(1)对实验I进行研究:
① 推测实验Ⅰ中黑色固体为Ag,则发生反应的离子方程式为_______________。
② 确认黑色固体为Ag的实验方案是___________________________________。
(2)对实验II进行研究:
① 反应开始时产生H2的原因可能是Mg和NH4+直接反应,或 ___________。
② “一段时间后”产生的气体一定含有H2和_____。
③ 为进一步研究,设计如下实验:
实验 | 操作 | 现象 |
实验IV | 向装有相同镁条的试管中加入2mL1.0mol/L(NH4)2SO4溶液 | 产生气体的速率明显慢于实验II |
结合实验II、IV,可以得出的结论是________________________________。
(3)对实验III进行研究:
①经检验,白色固体为碱式碳酸镁[ Mg2(OH)2CO3 ]。
②推测在pH=8.2的该溶液中,若无HCO3-,则H+和Mg反应的程度很小。通过实验证实了该推测,其实验操作是__________________________。
(4)根据上述实验判断,影响Mg与盐溶液反应多样性的原因有_______(填字母序号)
A.盐溶液中阳离子的氧化性 B.盐溶液的温度
C.含Mg生成物的溶解性 D.盐溶液中阴离子的影响
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关胶体和溶液的比较中正确的是( )
A. 溶液澄清透明,胶体浑浊不透明
B. 溶液呈电中性,胶体带有电荷
C. 光束通过溶液没有特殊现象,光束通过胶体有丁达尔效应
D. 溶液中溶质粒子的运动有规律,胶体粒子的运动无规律
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com