
科目: 来源: 题型:
【题目】下列现象或事实不能用同一原理解释的是( )
A.浓硝酸和氯水用棕色试剂瓶保存
B.硫化钠和亚硫酸钠固体长期暴露在空气中变质
C.常温下铁和铂都不溶于浓硝酸
D.SO2和Na2SO3溶液都能使氯水褪色
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学写出的下列烷烃的名称中,不符合系统命名法的是( )
A、2,3—二甲基己烷B、2—甲基丙烷
C、3—甲基—2—乙基戊烷 D、2,2,3,3—四甲基丁烷
查看答案和解析>>
科目: 来源: 题型:
【题目】利用下图进行实验,装置丙中实验现象正确的是
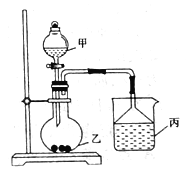
选项 | 装置甲 | 装置乙 | 装置丙 | 装置丙中的实验现象 |
A | 浓硫酸 | 亚硫酸钠 | 紫色石蕊试液 | 溶液先变红后褪色 |
B | 浓盐酸 | 二氧化锰 | 淀粉碘化钾试液 | 溶液变为蓝色 |
C | 浓氨水 | 氧化钙 | 硝酸银溶液 | 先有沉淀生成,后沉淀消失 |
D | 稀硫酸 | 碳酸钠 | 饱和碳酸钠溶液 | 先有沉淀生成,后沉淀消失 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】下表为长式周期表的一部分,其中的编号代表对应的元素。

(1)写出元素⑤的原子轨道表示式______________。
(2)写出元素⑨的基态原子的价电子排布式_________。
(3)表中属于ds区的元素是_________(填编号)
(4)元素⑩形成的单质是由____键形成的晶体,该晶体采取的堆积方式是_______,晶体中⑩元素原子的配位数是_________。
(5)元素④、⑤、⑥、⑦的离子半径由小到大的顺序是_______(用离子符号表示)
(6)写出元素①和元素⑧形成化合物的电子式_________________。
(7)元素⑨与⑩的第二电离能分别为:I⑨=1753kJ/mo1,I⑩=1959kJ/mo1,第二电离能I⑨⑩的原因是____________________________。
(8)科学家发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如下图所示(图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为______(用对应的元素符号表示)。

查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述中,不正确的是
A.石英坩埚、水泥、陶瓷都是硅酸盐产品
B.水晶、玛瑙的主要成分都是SiO2
C.二氧化硅能与氢氟酸反应,可利用此原理刻蚀玻璃
D.二氧化硅和大多数硅酸盐的化学性质都很稳定
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组用甲、乙两套装置(如图所示)进行丙烯酸(H2C=CHCOOH)与乙醇(CH3CH2OH)酯化反应的实验。已知:乙醇的沸点为78.5℃,丙烯酸的沸点为141℃,丙烯酸乙酯的沸点为99.8℃。
回答下列问题:
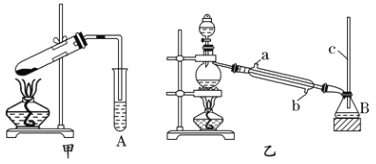
(1)仪器M的名称为_________,仪器A、B中的溶液均为 _________。
(2)甲、乙两套装置中效果比较好的装置是_______,原因是__________。
(3)乙装置中冷凝水应该从______(填“a”或“b”)口进入。
(4)若7.2g丙烯酸与5.2g乙醇完全反应,则理论上生成的丙烯酸乙酯的质量为________。(精确到小数点后一位)
查看答案和解析>>
科目: 来源: 题型:
【题目】我国“蛟龙”号载人潜水器的动力电源采用Al—Ag2O电池,其工作原理如图所示。下列说法正确的是
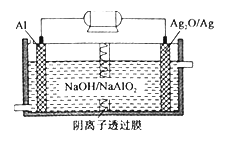
A. Al电极是该电池的正极
B. Ag2O在Ag2O/Ag电极上发生氧化反应
C. 该电池的负极反应为2Al -6e-+8OH-==2AlO2-+4H2O
D. 该电池工作时,正极区溶液的pH减小
查看答案和解析>>
科目: 来源: 题型:
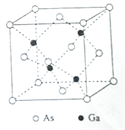
【题目】砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)写出基态As原子的核外电子排布式________________________。
(2)根据元素周期律,原子半径Ga_____________As,第一电离能Ga____________As。(填“大于”或“小于”)
(3)AsCl3分子的立体构型为____________________,其中As的杂化轨道类型为_________。
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是_____________________。
(5)GaAs的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如图所示。该晶体的类型为________________,Ga与As以________键键合。Ga和As的摩尔质量分别为MGa g·mol-1和MAs g·mol-1,原子半径分别为rGa pm和rAs pm,阿伏伽德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】1 mo1X能与足量碳酸氢钠溶液反应放出44.8 LCO2(标准状况),则X的分子式是( )
A. C5H10O4B. C4H8O4C. C3H6O4D. C2H2O4
查看答案和解析>>
科目: 来源: 题型:
【题目】已知碳化铝(Al4C3)与水反应生成氢氧化铝和甲烷。为了探究甲烷性质,某同学设计如下两组实验方案:
甲:方案探究甲烷与氧化剂反应(如图1所示);
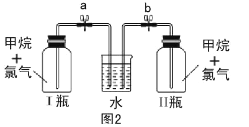
乙:方案探究甲烷与氯气反应的条件(如图2所示)。
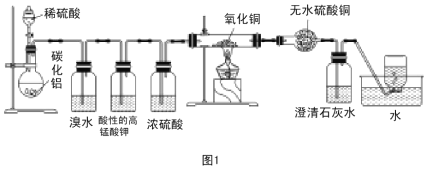
甲方案实验现象:溴水不褪色,无水硫酸铜变蓝色,澄清石灰水变浑浊。
乙方案实验操作过程:通过排饱和食盐水的方法收集两瓶甲烷与氯气(体积比为1:4)的混合气体,I瓶放在光亮处,II瓶用预先准备好的黑色纸套套上,按图2安装好装置,并加紧弹簧夹a和b。
(1)碳化铝与稀硫酸反应的化学方程式为__________。
(2)实验甲中浓硫酸的作用是 ______,集气瓶中收集到的气体 ____(填“能”或“不能”)直接排入空气中。
(3)下列对甲方案实验中的有关现象与结论的叙述都正确的是________(填标号)。
A.酸性高锰酸钾溶液不褪色,结论是通常条件下甲烷不能与强氧化剂反应
B.硬质玻璃管里黑色粉末无颜色变化,结论是甲烷不与氧化铜反应
C.硬质玻璃管里黑色粉末变红色,推断氧化铜与甲烷反应只生成水和二氧化碳
D.甲烷不能与溴水反应,推知甲烷不能与卤素单质反应
(4)写出甲方案实验中硬质玻璃管里可能发生反应的化学方程式:___(假设消耗甲烷与氧化铜的物质的量之比为2:7)
(5)—段时间后,观察到图2装置中出现的实验现象是 ________;然后打开弹簧夹a、b,现察到的实验现象是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com