
科目: 来源: 题型:
【题目】CO、H2、CH3、OH均是清洁能源。
(1)已知部分化学键键能数据如下:
化学键 | C | O=O | C=O | C-O |
E/(kJ mol-1) | 958.5 | 497 | 745 | 351 |
2CO(g) +O2(g)==2CO2(g) △H1
H2O(g)+CO(g)==H2(g) + CO2(g) △H2 = -41 kJmol-1
CH3OH(g)+ 3/2O2(g)==CO2(g)+2H2O(g) △H3 = -660kJmol-1
则△H1=_____ kJmol-1,反应CO(g)+2H2(g) ![]() CH3OH(g)的△H=_____ kJmol-1。
CH3OH(g)的△H=_____ kJmol-1。
(2)一定条件下,在容积为2 L的密闭容器Q中充人a mol CO与6 molH2合成甲醇:CO(g) +2H2(g) ![]() CH3OH(g)。测得平衡时混合气体中CH3OH的体积百分含量与温度、 压强之间的关系如图1所示,图2表示在一定温度下,H2的平衡转化率与反应开始时两种反应物的投料物质的量之比(用X表示)、压强之间的关系。
CH3OH(g)。测得平衡时混合气体中CH3OH的体积百分含量与温度、 压强之间的关系如图1所示,图2表示在一定温度下,H2的平衡转化率与反应开始时两种反应物的投料物质的量之比(用X表示)、压强之间的关系。

①压强相同时,温度为T1、T2时,反应达到平衡所需要的时间分别为t1、t2,则二者之间的相对大小为t1___ t2(填“>”、“<”、“=”或“无法确定”)。
②X=___________(用含a、b的式子表示),p1_____p2(填“>”、“<”、“=”或“无法确定”)。
③若a =2,b=4,则压强为p1、温度为了T1时该反应的平衡常数K=______________。
④若在压强为P1、温度为T1时,向Q容器中同时加入等物质的量的CO、H2、CH3OH三种气体,则反应开始时,v(CH3OH)正_____v(CH3OH)逆(填“>”、“<”、“=”或“无法确定”)。
(3)甲醇燃料电池是一种具有高能量转化率的绿色电池,则用磷酸溶液作电解质时,负极的电极反应式为________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中正确的是( )
A. 氯苯在NaOH的醇溶液中加热能发生消去反应
B. 通过核磁共振氢谱可以区分乙醇和乙酸乙酯
C. 分子式为C5H12O的醇,能在铜催化下被O2氧化为醛的同分异构体有5种
D. 苯酚与苯甲醇(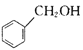 )分子组成相差一个CH2原子团,因而它们互为同系物
)分子组成相差一个CH2原子团,因而它们互为同系物
查看答案和解析>>
科目: 来源: 题型:
【题目】钒及其化合物广泛用于催化剂和新型电池等。工业上以富钒炉渣(主要成分V2O5、Fe2O3和SiO2等)为原料提取五氧化二钒的工艺流程如下图所示:
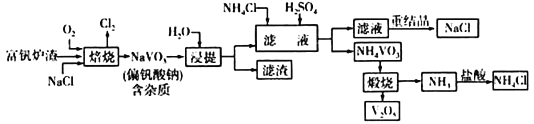
(1)该工艺流程中可以循环利用的物质有______________。
(2)焙烧炉中发生的主要反应化学方程式为___________________,焙烧炉中可用Na2CO3代替NaCl与富钒炉渣焙烧制得偏钒酸钠。用Na2CO3代替NaCl的优点是____________________。
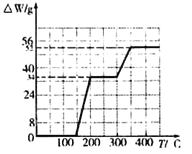
(3)234g固体偏钒酸铵在煅烧过程中,固体的质量减少值(△W)随温度变化的曲线如图所示。其分解过程中_________。(NH4VO3相对分子质量为117)
a.先分解失去NH3,再分解失去H2O
b.先分解失去H2O,再分解失去NH3
c.同时失去H2O和NH3
d.同时失去H2、N2和H2O
(4)为测定该产品的纯度,兴趣小组同学准确称取产品V2O5 2.0 g,加入足量稀硫酸使其完全生成(VO2)2SO4并配成250 mL溶液。取25.00 mL溶液用0.1000 mol· L-1的H2C2O4。标准溶液滴定,滴定到终点时消耗标准液10.00 mL。反应的离子方程式为:2VO2++ H2C2O4+2H+==2VO2++2CO2↑+2H2O。该产品的纯度为__________。
(5)V2O5具有强氧化性,能与盐酸反应生成氯气和VO+。该反应的离子反应方程式为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】对羟基扁桃酸是农药、香料合成的重要中间体,它可由苯酚和乙醛酸在一定条件下反应制得。
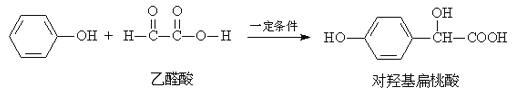
下列有关说法不正确的是( )
A. 上述反应的原子利用率可达到100%
B. 对羟基扁桃酸可以发生加成反应、取代反应和加聚反应
C. 在核磁共振氢谱中对羟基扁桃酸应该有6个吸收峰
D. 1mol对羟基扁桃酸与足量NaOH溶液反应,最多可消耗2molNaOH
查看答案和解析>>
科目: 来源: 题型:
【题目】北京奥运会主体育场“鸟巢”,被《泰晤士报》评为全球“最强悍”工程。“鸟巢”运用了高强度、高性能的钒氮合金高新钢,则钒原子的价电子排布式正确的是( )
A. 3s23p6B. 3d34s2C. 3d64s2D. 4s2
查看答案和解析>>
科目: 来源: 题型:
【题目】关于同分异构体数目的叙述不正确的是( )
A. 甲苯苯环上的1个氢原子被含3个碳原子的烷基取代,所得产物有6种
B. 已知丙烷的二氯代物有4种同分异构体,则其六氯代物的同分异构体数目也为4种
C. 菲的结构为 ,它与硝酸反应可生成5种一硝基取代物
,它与硝酸反应可生成5种一硝基取代物
D. 含有5个碳原子的某饱和链烃,其一氯代物有3种
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. 纳米材料是指一种称为“纳米”的新物质制成的材料
B. 绿色食品是指不含任何化学物质的食品
C. 生物固氮是指植物通过叶面直接吸收空气中的氮气
D. 光导纤维是以二氧化硅为主要原料制成的
查看答案和解析>>
科目: 来源: 题型:
【题目】CO2和CH4是两种温室气体,研究它们具有重要的意义。
(1)已知CH4、H2和CO的燃烧热(△H)分别为-890.3 kJ· mol-1、-285.8 kJ· mol-1和-283.0 kJ·mol-1。则![]()
![]() △H=_________kJ·mol-1
△H=_________kJ·mol-1
(2)以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示为: ![]()
![]() △H=-86.98 kJ·mol-1
△H=-86.98 kJ·mol-1
反应中影响CO2平衡转化率的因素很多,右图为某特定条件下,不同水碳比[n(H2O/n(CO2)]和温度对CO2平衡转化率的影响曲线。
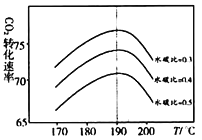
①为提高CO2的平衡转化率,生产中除控制温度外还可以采取的措施有___________________、____________________。
②当温度高于190℃后,CO2平衡转化率出现如图所示的变化趋势,其原因是_______________。
(3)向1.0 L密闭容器中通入0.2 mol NH3(g)和0.1 mol CO2(g),在一定温度下发生反应则![]()
![]() ,反应时间与气体总压强(p)的数据如下表:
,反应时间与气体总压强(p)的数据如下表:
![]() 用起始压强和总压强计算平衡时NH3的转化率为_________,0~80 min内CO2的平均反应速率是__________。
用起始压强和总压强计算平衡时NH3的转化率为_________,0~80 min内CO2的平均反应速率是__________。
(4)氨基甲酸铵(NH2COONH4)极易水解成碳酸铵,在酸性条件水解更彻底。将氨基甲酸铵粉末逐渐加入到1 L 0.1 mol·L-1的盐酸中直到pH=7(室温下,忽略溶液体积变化),共用去0.052 mol氨基甲酸铵,溶液中几乎不含碳元素。此时溶液中c(NH4+)=__________,NH4+水解平衡常数为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com