
科目: 来源: 题型:
【题目】硝酸生产中,500℃时,NH3和O2可能发生如下反应:
① 4NH3 (g) + 5O2 (g) ![]() 4NO (g) + 6H2O (g) △H= - 9072 kJ·mol-1K= 1.1×1026
4NO (g) + 6H2O (g) △H= - 9072 kJ·mol-1K= 1.1×1026
② 4NH3 (g) + 4O2 (g) ![]() 2N2O (g) + 6H2O (g) △H= - 1105 kJ·mol-1K= 4.4×1028
2N2O (g) + 6H2O (g) △H= - 1105 kJ·mol-1K= 4.4×1028
③ 4NH3 (g) + 3O2 (g) ![]() 2N2 (g) + 6H2O (g) △H= - 1269 kJ·mol-1K= 7.1×1034
2N2 (g) + 6H2O (g) △H= - 1269 kJ·mol-1K= 7.1×1034
其中,②、③是副反应。若要减少副反应,提高NO的产率,最合理的措施是
A.减小压强 B.降低温度
C.增大O2浓度 D.使用合适的催化剂
查看答案和解析>>
科目: 来源: 题型:
【题目】(13分)甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1=49.58 kJ·mol1
CH3OH(g)+H2O(g) ΔH1=49.58 kJ·mol1
反应Ⅱ:CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH2
CO(g)+H2O(g) ΔH2
反应Ⅲ:CO(g)+2H2(g)![]() CH3OH(g) ΔH3=90.77 kJ·mol1
CH3OH(g) ΔH3=90.77 kJ·mol1
回答下列问题:
(1)反应Ⅱ的ΔH2= 。
(2)反应Ⅲ能够自发进行的条件是 (填“较低温度”、“较高温度”或“任何温度”)。
(3)恒温,恒容密闭容器中,对于反应Ⅰ,下列说法中能说明该反应达到化学平衡状态的是 。
A.混合气体的密度不再变化
B.混合气体的平均相对分子质量不再变化
C.CO2、H2、CH3OH、H2O的物质的量之比为1∶3∶1∶1
D.甲醇的百分含量不再变化
(4)对于反应Ⅰ,不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法不正确的 是______。
A.不同条件下反应,N点的速率最大
B.温度低于250 ℃时,随温度升高乙烯的产率增大
C.M点时平衡常数比N点时平衡常数大
D.实际反应应尽可能在较低的温度下进行,以提高CO2的转化率

(5)若在1 L密闭容器中充入体积比为 3∶1的 H2 和CO2发生反应Ⅰ,则图中M点时,产物甲醇的体积分数为 ;该温度下,反应的平衡常数K= ;若要进一步提高甲醇的体积分数,可采取的措施有 。
查看答案和解析>>
科目: 来源: 题型:
【题目】(16分)磷的单质及其化合物在生产、生活中有着重要的用途。回答下列问题:
(1)直链低聚磷酸盐的化学式可表示为M(n+2)PnOx(M为+1价金属离子),则x= (用n表示)。
(2)H3PO2及NaH2PO2具有较强还原性,均可将溶液中的银离子还原为银单质,从而可用于化学镀银。
①H3PO2是一元弱酸,写出其电离方程式: 。NaH2PO2水溶液显_________(填“酸性”、“中性”、或者“碱性”)。
②H3PO2中,磷元素的化合价为_____,在碱性条件下,次磷酸盐可用于化学镀银,配平反应的离子方程式: ![]() + Ag+ +
+ Ag+ + ![]() + Ag↓ + 。
+ Ag↓ + 。
(3)H3PO2可以通过电解的方法制备。工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
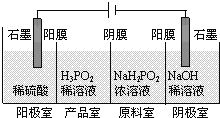
①写出阳极的电极反应式___________;
②分析产品室可得到H3PO2的原因___________;
③得到1 mol H3PO2的同时,阴极室制得NaOH质量为________g。
(4)含磷(主要为H3PO4、磷酸盐等)废水需加入生石灰调节pH将磷元素转化为磷酸的钙盐沉淀并回收。若处理后的废水中c(PO43)=4×107 mol·L1,则溶液中c(Ca2+)= mol·L1。(已知Ksp[Ca3(PO4)2]=2×1029)
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,有关下列四种溶液的叙述正确的是(忽略溶液混合的体积变化)
① | ② | ③ | ④ | |
pH | 12 | 12 | 2 | 2 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A. 在①、②中分别加入氯化铵晶体,两溶液的pH值均增大
B. 分别将等体积的①和②加水稀释100倍,所得溶液的pH:①>②
C. 把①、④两溶液等体积混合后所得溶液显酸性
D. 将溶液②和溶液③等体积混合,混合后所得溶液pH=7
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于金属与水的反应说法正确的是
A. 钠可以沉入水底与水剧烈反应
B. 由于铝锅可以用于烧水,因此铝不能跟沸水反应
C. 铁和冷水可以反应生成四氧化三铁和氢气
D. 金属的活泼性越弱,与水反应时需要的条件越苛刻
查看答案和解析>>
科目: 来源: 题型:
【题目】在一固定体积的密闭容器中,进行下列化学反应: ![]()
![]()
![]() 其化学平衡常数K和温度T的关系如下表:
其化学平衡常数K和温度T的关系如下表:
T/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
则下列有关叙述不正确的是 ( )
A. 该反应为吸热反应
B. 可测量容器总压变化来判定化学反应是否达到平衡
C. 若在某平衡状态时,c(CO2)·c(H2)=c(CO)·c(H2O),此时的温度为830℃
D. 若平衡时两种反应物的转化率相等,则起始投入时n(CO2):n(H2)=1:1
查看答案和解析>>
科目: 来源: 题型:
【题目】有一反应:2A+B![]() 2C,其中A、B、C均为气体,下图中的曲线是该反应在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有a、b、c三点,如图所示,则下列描述正确的是( )
2C,其中A、B、C均为气体,下图中的曲线是该反应在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有a、b、c三点,如图所示,则下列描述正确的是( )

A. 该反应是放热反应
B. b点时混合气体的平均摩尔质量不再变化
C. T1温度下若由a点达到平衡,可以采取增大压强的方法
D. 在达到平衡的过程中,c点v(正)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.焓变是指1 mol物质参加反应时的能量变化
B.当反应放热时ΔH>0,反应吸热时ΔH<0
C.在加热条件下发生的反应均为吸热反应
D.一个化学反应中,当反应物总能量大于生成物总能量时,ΔH为“-”
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A.丙烷分子中所有碳原子在一条直线上
B.乙醇和乙醚互为同分异构体
C.金刚石、石墨、C60、 富勒烯互为同素异形体
D.臭氧和氧气互为同素异形体,两者之间的转化不属于化学变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com