
科目: 来源: 题型:
【题目】化合物M是二苯乙炔类液晶材料的一种,最简单的二苯乙炔类化合物是![]() 。以互为同系物的单取代芳烃A、G为原料合成M的一种路线(部分反应条件略去)如下:
。以互为同系物的单取代芳烃A、G为原料合成M的一种路线(部分反应条件略去)如下:
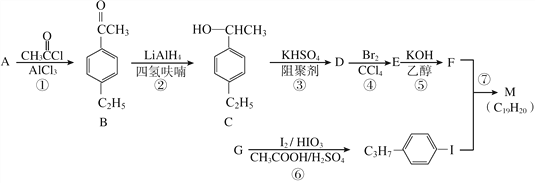
回答下列问题:
(1)A的结构简式为________。
(2)D分子中最多有________个碳原子共平面。
(3)①的反应类型是________,④的反应类型是________。
(4)⑤的化学方程式为____________________________________________。
(5)B的同分异构体中能同时满足如下条件:①苯环上有两个取代基,②能发生银镜反应,共有________种(不考虑立体异构),其中核磁共振氢谱为5组峰,且峰面积比为6:2:2:1:1的是________(写结构简式)。
(6)参照上述合成路线,设计一条由苯乙烯和甲苯为起始原料制备![]() 的合成路线:___________________________________。
的合成路线:___________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化铁是一种常见的水处理剂,无水氯化铁遇潮湿空气,极易吸水生成FeCl3nH2O。在实验室中,可以采用下列仪器和药品制取较纯的无水氯化铁固体。

(1)实验开始时,先点燃____处的酒精灯(填A或D)。A中发生反应的化学方程式为____________________________________________。
(2)B装置中盛放的是饱和食盐水,其作用为__________________________________
(3)F装置中的试剂为浓硫酸,其作用是防止G中的水蒸气进入E中。用一件仪器装填适当试剂后,也可起到F和G的作用,所装填的试剂为_______________。
(4)G装置中反应的离子方程式为_____________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(14分)工业上可以采用热还原法制备金属镁(镁沸点为1107℃,熔点是648.8℃)。
(1)将碱式碳酸镁[4MgCO3·Mg(OH)2·5H2O]和焦炭按一定比例混合,放入真空管式炉中先升温至500℃保持一段时间,然后升温至1450℃反应制得镁。
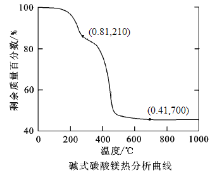
①用碳还原法制备金属镁需要在真空中而不在空气中进行,其原因是 。
②焦炭与碱式碳酸镁的物质的量的比值不同对镁的还原率有较大影响,结果如图。当比值大于15∶1时,还原率下降的原因可能是 。
③碱式碳酸镁分解如图所示,写出在1450℃反应制得镁的化学反应方程式 。

(2)工业上可以采用MgCl2溶液和Na2CO3溶液混合制备碱式碳酸镁,写出反应离子方程式 。
反应采用68℃,温度不宜高于68℃的原因是 。
(3)工业采用电解MgCl2溶液产生Mg(OH)2,如图。然后用Mg(OH)2悬浊液吸收烟气中的二氧化碳,减少二氧化碳的排放同时产生碱式碳酸镁。该电池的阴极电极反应式为 。电解时还得到副产物为 。

查看答案和解析>>
科目: 来源: 题型:
【题目】A~H八种短周期主族元素在周期表中的相对位置如下图所示,已知C元素形成的单质有“国防金属”的美誉,E的最高价氧化物对应的水化物能与E的最简单氢化物反应生成离子化合物。

(1)写出B、G对应的元素符号______________ 。
(2)D元素在周期表中的位置为______________。
(3)B、E、F的简单离子半径由大到小的顺序为______________(写离子符号)。
(4)上述元素所形成的气态单质中能用于饮用水消毒的是______________(写化学式)。
(5)B的单质在F的单质中燃烧的火焰颜色为______________,所形成化合物的电子式为______________。
(6)C元素的单质可以在D和F组成的一种气态化合物中燃烧,写出该反应的化学方程式________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】绿原酸是从金银花中提取出的有很高药用价值的有机物,其结构如下图所示,下列说法正确的是
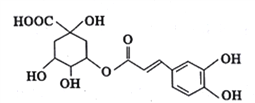
A. 绿原酸分子中有4种含氧官能团
B. 绿原酸能发生取代、加成、消去和氧化反应
C. 绿原酸在酸性条件下的水解产物均能与FeCl3发生显色反应
D. l mol绿原酸与足量钠反应,可生成4 molH2
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ氢、碳、氮都是重要的非金属元素,它们的单质及其化合物在科学研究和工业生产中有重要的应用。
(1)下列微粒基态的电子排布中未成对电子数最多的是__(填序号)
a.N3- b.Fe3+ c.Cu d.Cr e.C
(2)第一电离能介于B、N之间的第二周期元素有_____种。
(3)已知HCO3-在水溶液中可通过氢键成为二聚体(八元环结构),试画出该二聚体的结构式:____________________________。
(4)[Zn(CN)4]2-在水溶液中与HCHO发生如下反应:
4HCHO+[Zn(CN)4]2-+4H++4H2O![]() [Zn(H2O)4]2++4HOCH2CN
[Zn(H2O)4]2++4HOCH2CN
①Zn2+基态核外电子排布式为____。1 mol HCHO分子中含有σ键的物质的量为____mol。
②HOCH2CN分子中碳原子轨道的杂化类型是__。与H2O分子互为等电子体的阴离子为__。
③[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键,不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为______。
Ⅱ.由原子序数由小到大的A、B、C、D、E五种元素构成某配位化合物X,其原子个数比为14∶4∶5∶1∶1。其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-1)dn+6ns1,回答下列问题。
(1)该配位化合物X的化学式为________。
(2)元素B、C、D的第一电离能由小到大排列顺序为________。(用元素符号表示)
(3)D元素原子的最外层电子轨道表示式为________。
(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1∶1和1∶2,两种化合物可任意比互溶,解释其主要原因为_______________________。
(5)A元素与E元素可形成一种红色离子化合物Y,其原子个数比为1∶1,该化合物Y可与稀硝酸反应,生成一种蓝色溶液和两种无色气体(其中一种为A元素的单质),写出该反应的化学方程式_____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】电镀工业会产生大量的电镀污水,处理某独酸性电镀废液(主要含Cu2+、Fe3 +)以制备氯化亚铜的工艺流程如图所示:
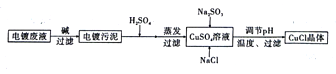
已知:① 氯化亚铜(CuCl)是白色粉末,微溶于水,不溶于乙醇,在空气中会被迅速氧化成绿色碱式盐。
② 常温下,
物质 | Fe(OH)3 | Cu(OH)2 |
Kap | 4.0×10-38 | 5.0×10-20 |
请回答下列问题:
(1)加H2SO4的步骤中,下列措施,可提高溶解速率的是_______(填序号)。
a.加热 b.增大压强 c.延长浸出时间 d.适当提高硫酸的浓度
(2)电镀污泥的主要成分是____,产品CuCl晶体要用无水乙醇洗涤、真空干燥、密封包装的目的是______________。
(3)加入H2SO4的目的是_________。
(4)亚硫酸钠、氯化钠、硫酸铜在溶液中反应生成CuCl的离子方程式为__________。
(5)实验探究pH对CuCl产率的影响如图 所示,当pH=2时CuCl 产率最大的原因是_________
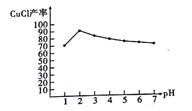
(6)以碳棒为电极电解CuCl2溶液也可得到CuCl。写出电解CuCl2溶液阴极的反应方程式:_______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com