
科目: 来源: 题型:
【题目】孔雀石的主要成分为CuCO3·Cu(OH)2某同学设计从孔雀石中冶炼铜的方案如下:
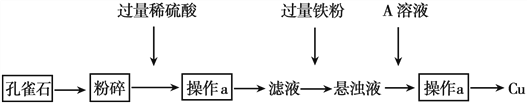
回答下列问题:
(1)将孔雀石粉碎的目的是_________,加入过量稀硫酸,可观察到的现象是_________
(2)操作a的名称是________,在滤液中加入过量铁粉发生的反应有_______________(用离子方程式表示)
(3)A的化学式为_________,在悬浊液中加入A的目的是___________
(4)从滤液中获得铜的另外一种方案是:2CuSO4+ 2H2O![]() 2Cu+O2↑+2H2SO4现有111 kgCuCO3·Cu(OH)2,通过这种方案理论上可以制取_________kg铜
2Cu+O2↑+2H2SO4现有111 kgCuCO3·Cu(OH)2,通过这种方案理论上可以制取_________kg铜
(5)请你根据提供的试剂,设计由孔雀石冶炼铜的另外一种方案(请用简洁的文字说明)__________(可供选择试剂:铁粉稀硫酸)
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下,对于密闭容器中进行的可逆反应:2SO2(g)+O2(g)![]() 2SO3(g)下列说法错误的是( )
2SO3(g)下列说法错误的是( )
A. 改变反应条件可以改变该反应的限度 B. 增大压强,正逆反应速率都增大
C. 达到平衡时,SO2O2SO3在容器中共存 D. 达到平衡时,SO2与SO3的浓度相等
查看答案和解析>>
科目: 来源: 题型:
【题目】检验氨气正确的方法是
A. 靠近蘸有浓硫酸的玻璃棒,有白烟
B. 靠近蘸有浓盐酸的玻璃棒,有白烟
C. 用湿润的蓝色石蕊试纸,试纸变红
D. 用湿润的淀粉碘化钾试纸,试纸变蓝
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,在2 L密闭容器内,反应2NO2(g)![]() N2O4(g) ΔH=-180 kJ·mol-1,n(NO2)随时间变化如下表:
N2O4(g) ΔH=-180 kJ·mol-1,n(NO2)随时间变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 0.040 | 0.020 | 0.010 | 0.005 | 0.005 | 0.005 |
(1)用NO2表示0~2 s内该反应的平均速度___________.在第5 s时,NO2的转化率为_____。根据上表可以看出,随着反应进行,反应速率逐渐减小,其原因是_____________________。
(2)上述反应在第3 s后达到平衡,能说明该反应已达到平衡状态的是______。
a.单位时间内,消耗2 mol NO2的同时生成1 mol的N2O4
b.容器内压强保持不变
c.v逆(NO2)=2v正(N2O4)
d.容器内密度保持不变
(3)在2 s内,该反应_______(“吸收”或“放出”) _______热量。
查看答案和解析>>
科目: 来源: 题型:
【题目】铈是地壳中丰度最高稀土元素,二氧化铈(CeO2)是其重要的化合物。平板液晶显示屏生产过程中产生大量的废玻璃粉末,其中含CeO2、SiO2、Fe2O3等物质,某实验小组以此粉末为原料回收铈,设计流程如下:

(1)步骤Ⅰ加入过量盐酸后,溶液a中的阳离子有__________,固体b的成分是__________。
(2)步骤Ⅱ中反应的离子方程式为______________________。
(3)当溶液中离子浓度小于1×10-6mol·L-1时视为沉淀充全,则步骤Ⅲ中加入NaOH调节溶液的pH应大于________________[己知:Ce(OH)3的Ksp=8.0×10-21,1g2=0.3 ]。第V步反应的化学方程式是______________________。
(4)步骤Ⅳ中的实验操作包括_____________。将NH4Cl固体与CeCl3·6H2O混合真空加热可得无水CeCl3,其中加入NH4Cl的作用是_______________________。
(5)无水CeCl3是重要的分析试剂,现欲对CeCl3样品纯度进行测定,其方法是:准确称取样品wg配成100.00 mL溶液,取25.00 mL 置于锥形瓶中,加入和过量的过硫酸铵溶液将Ce3+ 氧化为Ce4+,然后用莘取剂[用(HT)2表示]萃取Ce4+,再用c mol/L (NH4)2Fe(SO4)2标准溶液滴定至终点(Ce4+被还原为Ce3+),重复 2-3次,平均消耗VmL标准溶液。
①“萃取”时存在反应:Ce4++n(HT)2![]() Ce(H2n-4T2n)+4H+,若要提高滴定的准确率,应使溶液呈____________性(填“酸”、“碱”或“中”)。若未进行“萃取”,经计算所得结果偏高,其原因是______________________。
Ce(H2n-4T2n)+4H+,若要提高滴定的准确率,应使溶液呈____________性(填“酸”、“碱”或“中”)。若未进行“萃取”,经计算所得结果偏高,其原因是______________________。
②经计算,CeCl3样品的纯度为____________。 [M(CeCl3) =246.5g/mol]
查看答案和解析>>
科目: 来源: 题型:
【题目】在给定的条件下,下列选项中所示的物质间的转化均能一步实现的是
A. N2 ![]() NH3
NH3 ![]() NH4Cl2(aq)
NH4Cl2(aq)
B. AgNO3![]() [Ag(NH3)2]OH(aq)
[Ag(NH3)2]OH(aq) ![]() Ag
Ag
C. SiO2![]() SiCl4
SiCl4![]() Si
Si
D. MgCO3![]() MgCl2(aq)
MgCl2(aq) ![]() Mg
Mg
查看答案和解析>>
科目: 来源: 题型:
【题目】称取两份铝粉,第一份加足量NaOH溶液,第二份加足量硫酸,如果要得到相同体积(同温同压)的氢气,两份铝粉的质量比是( )
A. 1∶1 B. 1∶3 C. 3∶2 D. 1∶2
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 是一种有机烯醚,可由链烃A通过下列路线制得,下列说法正确的是
是一种有机烯醚,可由链烃A通过下列路线制得,下列说法正确的是

A. B中含有的官能团有溴原子、碳碳双键
B. A的结构简式是CH2=CHCH2CH3
C. 该有机烯醚不能发生加聚反应
D. ①②③的反应类型分别为加成反应、取代反应、消去反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com