
科目: 来源: 题型:
【题目】意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子,N4分子结构与白磷(P4)相同,如图所示,己知断裂1molN-N键吸收167kJ能量,生成1molN≡N放出942kJ能量,根据以上倍息和数据判断下列说法正确的是()

A. N4分子是一种新型化合物 B. N4和N2互为同位素
C. N4化学性质比N2稳定 D. lmolN4转变为N2将放出882kJ的能量
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应中,反应后固体质量减轻的是( )
①氨气通过灼热的CuO粉末
②二氧化碳通过Na2O2粉末
③水蒸气通过灼热的Fe粉
④Zn投入CuSO4溶液.
A. ①② B. ①④ C. ②③ D. ②④
查看答案和解析>>
科目: 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )
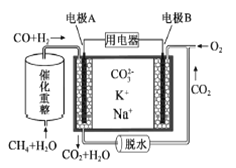
A. 反应CH4+H2O![]() 3H2+CO,每消耗1molCH4转移12mol 电子
3H2+CO,每消耗1molCH4转移12mol 电子
B. 电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
C. 电池工作时,CO32-向电极B移动
D. 电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
查看答案和解析>>
科目: 来源: 题型:
【题目】下列化学用语表述一定正确的是
A.甲醛的电子式:![]()
B.苯酚钠溶液中中通入少量二氧化碳气体:![]()
C.溴乙烷与氢氧化钠水溶液共热:![]()
D.乙醇与灼热的氧化铜反应:CH3CH2OH+CuO![]() CH3CHO+Cu+H2O
CH3CHO+Cu+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】设阿伏加德罗常数的值为NA,下列说法中正确的是( )
A. 标准状况下,2.24LCHC13含有的分子数为0.1NA
B. 0.1molCnH2n+2中含有的碳碳单键数为0.1nNA
C. 2.8g乙烯和丙烯的混合气体中所含碳原子为0.2NA
D. 1mol苯乙烯中含有的碳碳双键数为4NA
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关物质性质与用途具有对应关系的是
A. H2O2具有强氧化性,可用作消毒剂
B. Fe2(SO4)3易溶于水,可用作净水剂
C. NH3具有还原性可用作制冷剂
D. C2H4具有可燃性可用作催熟剂
查看答案和解析>>
科目: 来源: 题型:
【题目】氯气是一种重要的化工原料,在生产和生活中的应用十分广泛。某化学兴趣小组在实验室中对Cl2与FeCl2和KSCN混合溶液的反应进行了探究。回答下列问题:
(1)氯气的制备

①氯气的发生装置可以选择上图中的_________,反应的化学方程式为_________________。
②欲收集一瓶干燥纯净的氯气,选择上图中的装置,其连接顺序为______________(按气流方向,用小写字母表示)。
(2)Cl2与FeCl2和KSCN混合溶液的反应

随着Cl2不断通入,A装置中溶液先变红,后由红色变为黄色。
装置B中发生反应的离子方程式为___________________________________________。
(3)实验探究
为了探究A装置中溶液由红色变为黄色的原因,该小组进行了如下实验:
实验一:取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成。
实验二:取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液。
该兴趣小组根据实验现象,猜想是SCN可能被Cl2氧化了,他们又进行了如下研究。
查阅资料显示:SCN的电子式为![]() 。
。
①该兴趣小组认为SCN中碳元素没有被氧化,理由是____________________________。
②取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN中被氧化的元素是________(填元素名称)。
③通过实验证明了SCN中氮元素转化为NO3,他们的实验方案是__________________________________________________________________________________________________。
根据以上实验探究结论写出SCN与Cl2反应的离子方程式为__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】三盐基硫酸铅(3PbO·PbSO4·H2O)简称三盐,白色或微黄色粉末,稍带甜味、有毒。200℃以上开始失去结晶水,不溶于水及有机溶剂。可用作聚氯乙烯的热稳定剂。以100.0吨铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐的工艺流程如下图所示。

已知:Ksp(PbSO4)=1.82×10-8,Ksp(PbCO3)=1.46×10-13。
请回答下列问题:
(1)步骤①转化的目的是_________,滤液1中的溶质为Na2CO3和______(填化学式)。
(2)步骤③酸溶时,为提高酸溶速率,可采取的措施是____________________。(任写一条)。其中铅与硝酸反应生成Pb(NO3)2和NO的离子方程式为____________。
(3)滤液2中可循环利用的溶质为__________(填化学式)。若步骤④沉铅后的滤液中c(Pb2+)=1.82×l0-5mol ·L-1,则此时c(SO42-)________mol·L-1。
(4)步骤⑥合成三盐的化学方程式为_________。若得到纯净干燥的三盐49.5t,假设铅泥中的铅元素有80%转化为三盐,则铅泥中铅元素的质量分数为__________。简述步骤⑦洗涤沉淀的方法_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】碱式次氯酸镁[Mg2ClO(OH)3H2O]微溶于水,不潮解,相对稳定,是一种有开发价值的无机抗菌剂,以菱镁矿(MgCO3,含少量FeCO3)为主要原料制备碱式次氯酸镁的工业流程如下:
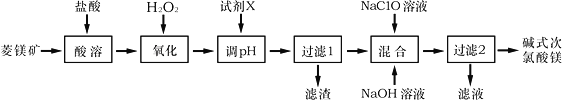
回答下列问题:
(1)菱镁矿“酸溶”时,为了提高溶出率,可采取的措施有________________(写一条)。
(2)H2O2的电子式为___________,它的作用是___________________________________。
(3)“调pH”时加入的试剂X为______________(填化学式)。
(4)“混合”时发生反应的化学方程式为__________________________________________。
“混合”时NaOH溶液需最后加入且不能过量,其原因是__________________________。
(5)在酸性溶液中碱式次氯酸镁具有杀菌、漂白作用的原因是_____________(用离子方程式表示)。
(6)如果以单位质量的消毒剂所得到的电子数来表示消毒效率,碱式次氯酸镁的消毒效率是Cl2的消毒效率的_______倍(计算结果保留两位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com