
科目: 来源: 题型:
【题目】氯气是一种重要的工业原料。工业上利用下列反应来检查氯气管道是否漏气:3Cl2+8NH3=N2+6NH4Cl,下列说法错误的是
A. 若有白烟产生则管道漏气 B. 该反应中NH4Cl是还原产物
C. 反应中NH3只显还原性 D. 生成1.4gN2时转移0.3mol电子
查看答案和解析>>
科目: 来源: 题型:
【题目】现今太阳能光伏产业蓬勃发展,推动了高纯硅的生产与应用。回答下列问题:
Ⅰ.工业上用“西门子法”以硅石(SiO2)为原料制备冶金级高纯硅的工艺流程如下图所示:
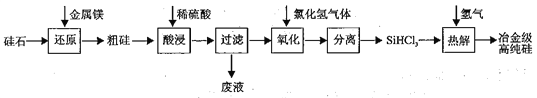
己知:SiHCl3 室温下为易挥发、易水解的无色液体。
(1)“还原”过程需要在高温条件下,该反应的主要还原产物为_____________。
(2)“氧化”过程反应温度为200~300℃,该反应的化学方程式为__________。
(3)“氧化”、“分离”与“热解”的过程均需要在无水、无氧的条件下,原因是_________________。
(4)上述生产工艺中可循环使用的物质是_________、________(填化学式)。
Ⅱ.冶金级高纯硅中常含有微量的杂质元素,比如铁、硼等,需对其进行测定并除杂,以进一步提高硅的纯度。
(5)测定冶金级高纯硅中铁元素含量
将m g 样品用氢氟酸和硝酸溶解处理,配成V mL 溶液,用羟胺(NH2OH,难电离)将Fe3+还原为Fe2+后,加入二氮杂菲,形成红色物质。利用吸光度法测得吸光度A 为0.500(吸光度A与Fe2+浓度对应曲线如图)。
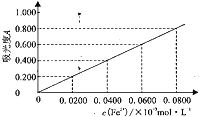
① 酸性条件下,羟胺将Fe3+还原为Fe2+,同时产生一种无污染气体,该反应的离子方程式为__________________________________。
② 样品中铁元素的质量分数表达式为____________________(用字母表示)。
(6)利用氧化挥发法除冶金级高纯硅中的硼元素
采用Ar等离子焰,分别加入O2或CO2,研究硼元素的去除率和硅元素的损失率,实验结果如下图所示。在实际生产过程,应调节O2或CO2的合理比例的原因是________________。

查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 钠与水反应:Na+H2O= Na++OH-+H2↑
B. 铁与硫酸铁溶液反应:Fe+Fe3+ = 2Fe2+
C. 氢氧化镁与稀盐酸反应:Mg(OH)2+2 H+ = Mg2++2H2O
D. 碳酸氢钠溶液中滴入氢氧化钠溶液:OH —+HCO3-= H2O+CO2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于用一定浓度的盐酸滴定氢氧化钠溶液的操作中错误的是
A.滴定时眼睛注视滴定管读数
B.滴定管用蒸馏水洗净后再用标准盐酸润洗
C.滴定时要不断振荡锥形瓶
D.要做3次平行实验求其平均值
查看答案和解析>>
科目: 来源: 题型:
【题目】将某份铁铝合金样品均分为两份,一份加入足量盐酸,另一份加入足量NaOH溶液,同温同压下产生的气体体积比为3∶2,则样品中铁、铝物质的量之比为
A. 3∶2 B. 2∶1 C. 3∶4 D. 4∶3
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素W、X 、Y 和Z 在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21 。回答下列问题:
W | X | |||
Y | Z |
(1)X 在元素周期表中的位置为_______。
(2)四种元素简单离子的半径由大到小为_____________(用离子符号表达)。
(3)W的最简单氢化物的电子式为________________。
(4)W、Z 最高价氧化物的水化物酸性较强的为___________(填化学式)。
(5)Y单质与Fe2O3 反应能放出大量的热,常用于焊接钢轨,该反应化学方程式为____________________。
(6)向盛有3 mL 鸡蛋清溶液的试管里滴入几滴W的最高价氧化物的水化物浓溶液,实验现象为________________________________________。
(7)C3H7Z 的结构简式有____________________。
(8)ZX2气体是一种广谱杀菌消毒剂。工业上可利用NaZX3和NaZ 在酸性条件下制得ZX2 同时得到Z元素的单质,该反应的离子方程式为_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】用0.100mol/L的HCl溶液滴定某未知浓度的NaOH,用甲基橙作指示剂,达到滴定终点时溶液颜色的变化是
A.黄色变橙色B.橙色变黄色
C.红色变橙色D.橙色变红色
查看答案和解析>>
科目: 来源: 题型:
【题目】乙醇是重要的有机化工原料,也是优质的燃料,工业上可由乙烯水合法或发酵法生产。回答下列问题:
(1)乙烯水合法可分为两步
第一步:反应CH2=CH2+ HOSO3H(浓硫酸)→CH3CH2OSO3H(硫酸氢乙醋);
第二步:硫酸氢乙酯水解生成乙醇。
① 第一步属于反应____________________(填反应类型)。
② 第二步反应的化学方程式为__________________________________。
③ 上述整个过程中浓硫酸的作用是___________________________________。
(2)发酵法制乙醇,植物秸秆(含50%纤维素)为原料经以下转化制得乙醇
植物秸秆—水解→C6H12O6—酒化酶→2CH3CH2OH+2CO2↑
![]()
纤维素的化学式为_______________,现要制取4.6 吨乙醇,至少需要植物秸秆________吨。
(3)乙醇汽油是用90%的普通汽油与10 %的燃料乙醇调和而成。乙醇汽油中乙醇是可再生能源,来源于_______________(填“乙烯水合法”或“发酵法”)。
(4)以乙醇为原料可制备某种高分子涂料,其转化关系如下图:
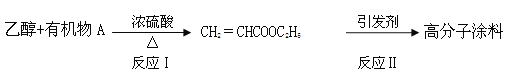
① 有机物A 的结构简式为____________。
② 反应Ⅱ的化学方程式为_____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某有机高分子合成材料K的合成路线如下图(部分反应条件和产物略去)所示。
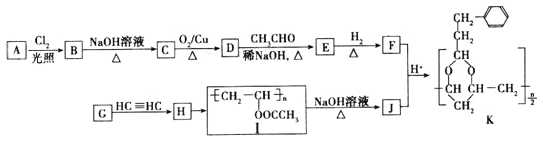
请回答下列问题:
已知:
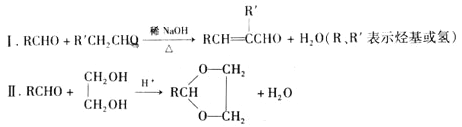
(1)A是相对分子质量为92的芳香烃,则A的分子式为_____________,G→H的反应类型为__________________。
(2)检验E中含氧官能团的试剂为_________________(填名称)。
(3)符合下列条件的有机物F的同分异构体有________种(不考虑顺反异构);其中核磁共振氢谱中有5组峰,且峰面积之比为3:2:2:2:1的是_________________(写结构简式)。
①遇FeCl3溶液显紫色;
②能与溴水发生加成反应;
③属于芳香化合物。
(4)写出F和J反应生成K的化学方程式__________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上曾经通过反应“3Fe+4NaOH![]() Fe3O4+2H2↑+4Na↑”生产金属钠。下列有关说法正确的是
Fe3O4+2H2↑+4Na↑”生产金属钠。下列有关说法正确的是
A. 不能用磁铁将Fe与Fe3O4分离
B. 将生成的气体在空气中冷却可获得钠
C. 该反应条件下铁的氧化性比钠强
D. 该反应中每生成2 mol H2,转移的电子数约为4×6.02×1023
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com