
科目: 来源: 题型:
【题目】下图是元素周期表的一部分,表中列出了①⑨种元素的位置,请根据要求回答问题。
族 周期 | IA | ⅡA | ⅢA | ⅣA | VA | VIA | ⅦA | 0 |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ |
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为________________。
(2)②与④形成的化合物的电子式可表示为 _________________________________________。
(3)这些元素的最髙价氧化物对应的水化物中,酸性最强的是____________________(填化学式)。
(4)写出⑤与氢氧化钠溶液反应的化学方程式:_____________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究小组利用如图装置探究SO2和Fe(NO3)3溶液的反应原理。回答下列问题:
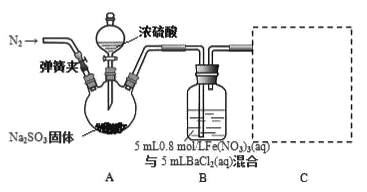
(1)在实验室中,欲配制250g70%的浓硫酸,需要的玻璃仪器除量筒、烧杯外,还需要有__________,装置A中盛放浓硫酸的仪器名称是___________。
(2)往三颈烧瓶中通入N2的操作在滴加浓硫酸(填“之前”或“之后”),其目的是______________。
(3)三颈烧瓶中发生反应的化学方程式为_____________________,该反应中浓硫酸表现出的性质为______________。
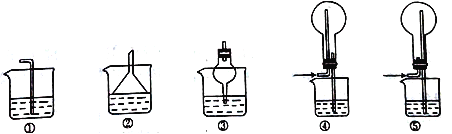
(4)SO2易溶于水,下列装置可用于C处虚线框内吸收尾气的是___________(填编号)。
(5)装置B中产生白色沉淀的原因有两种可能。若要证明Fe3+能氧化SO2,则需要改进的地方是___________________,改进后若得到肯定结论,则装置B中发生反应的离子方程式为___________________、____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮的化合物应用广泛,但氮氧化物是重要的空气污染物,应降低其排放。
(1)用CO2和NH3可合成氮肥尿素[CO(NH3)2]
已知:①2NH3(g)+CO2(g)=NH2CO2NH4 (s) △H=-159.5 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) △H=+116.5 kJ·mol-1
③H2O(l)=H2O(g) △H=+44 kJ·mol-1
用CO2和NH3合成尿素(副产物是液态水)的热化学方程式为______________。
(2)工业上常用如下反应消除氮氧化物的污染:
CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) △H
N2(g)+CO2(g)+2H2O(g) △H
在温度为T1和T2时,分别将0.40molCH4和1.0molNO2充入体积为1L的密闭容器中,n(CH4)随反应时间的变化如右图所示:

①根据右图判断该反应的△H________0(填“>”、“<”或“=”),理由是______________。
②温度为T1时,0~10min内NO2的平均反应速率v(NO2)=__________,反应的平衡常数K=___(保留三位小数)
③该反应达到平衡后,为在提高反应速率同时提高NO2的转化率,可采取的措施有______(填标号)。
A.改用高效催化剂 B.升高温度
C.缩小容器的体积 D.增加CH4的浓度
(3)利用原电池反应可实现NO2的无害化,总反应为6NO2+8NH3=7N2+12H2O,电解质溶液为NaOH溶液,工作一段时间后,该电池正极区附近溶液pH________(填“增大”、“减小”或“不变”),负极的电极反应式为___________________。
(4)氮的一种氢化物HN3,其水溶液酸性与醋酸相似,则NaN3溶液中各离子浓度由大到小的顺序为________;常温下,将amol·L-1 的HN3与bmol·L-1 的Ba(OH) 2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(N3-),则该混合物溶液呈_______(填“酸”、“碱”或“中”)性,溶液中c(HN3)=_________ mol·L-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】最近我国科学家发明“可充电钠-二氧化碳电池”(如图),放电时电池总反应为:4Na+3CO2 = 2Na2CO3+C。下列说法错误的是
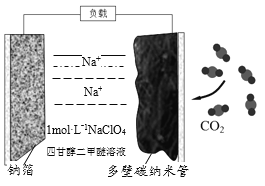
A. 电池工作温度可能在200℃以上
B. 该装置可以将化学能转化为电能
C. 放电时,Na+向正极移动
D. 放电时,正极的电极反应为:4Na++3CO2+4e-=2Na2CO3+C
查看答案和解析>>
科目: 来源: 题型:
【题目】研究表明,化学反应的能量变化与反应物和生成物的键能有关。键能可以简单的理解为断开1mol 化学键时所需吸收的能量。下表是部分化学键的键能数据:
化学键 | P﹣P | P﹣O | O=O | P=O |
键能/kJ·mol﹣1 | 197 | X | 499 | 434 |
已知白磷的燃烧方程式为:P4(s)+5O2(g)=P4O10(s),该反应放出热量2378.0 kJ,且白磷分子结构为正四面体,4个磷原子分别位于正四面体的四个顶点,白磷完全燃烧的产物结构如下图所示,则下表中X为
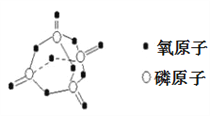
A. 410 B. 335 C. 360 D. 188
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,在体积为2L的恒容密闭容器中,某一反应中X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列
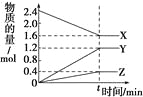
表述中正确的是
A. 反应的化学方程式为2X = 3Y + Z
B. t时,正、逆反应都不再继续进行,反应达到化学平衡
C. 若t=4,则0~t的X的化学反应速率为0.1 molL-1min-1
D. 温度、体积不变,t时刻充入1 mol He使压强增大,正、逆反应速率都增大
查看答案和解析>>
科目: 来源: 题型:
【题目】高锰酸钾是常用的氧化剂。工业上以软锰矿(主要成分是MnO2)为原料制备高锰酸钾晶体。中间产物为锰酸钾。下图是实验室模拟制备KMnO4晶体的操作流程:

已知:锰酸钾(K2MnO4)是墨绿色晶体,其水溶液呈深绿色,这是锰酸根离子(MnO42-)在水溶液中的特征颜色,在强碱性溶液中能稳定存在;在酸性、中性和弱碱性环境下,MnO42-会发生自身氧化还原反应,生成MnO4-和MnO2。
回答下列问题:
(1)KOH的电子式为______,煅烧KOH和软锰矿的混合物应放在_______中加热(填标号)。
a.烧杯 b.瓷坩埚 c.蒸发皿 d.铁坩埚
(2)调节溶液pH过程中,所得氧化产物与还原产物的物质的量之比为______。
(3)趁热过滤的目的是_______________________________。
(4)已知20℃时K2SO4、KCl、CH3COOK的溶解度分别为11.1g、34g、217g,则从理论上分析,选用下列酸中__________(填标号),得到的高锰酸钾晶体纯度更高。
a.稀硫酸 b.浓盐酸 c.醋酸 d.稀盐酸
(5)产品中KMnO4的定量分析:
①配制浓度为0.1250mg·mL-1的KMnO4标准溶液100mL。
②将上述溶液稀释为浓度分别为2.5、5.0、7.5、10.0、12.5、15.0(单位:mg·L-1)的溶液,分别测定不同浓度溶液对光的吸收程度,并将测定结果绘制成曲线如下。
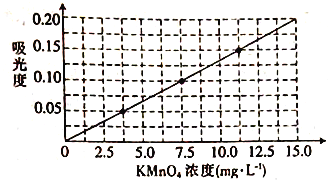
③称取KMnO4样品(不含K2MnO4)0.1250g按步骤①配得产品溶液1000mL,取10mL稀释至100mL,然后按步骤②的方法进行测定,两次测定所得的吸光度分别为0.149、0.151,则样品中KMnO4的质量分数为____。
(6)酸性KMnO4溶液与FeSO4溶液反应的离子方程式为_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是(NA为阿伏加德罗常数)
A.124 g P4含有P—P键的个数为4NA
B.12 g石墨中含有C—C键的个数为1.5NA
C.12 g金刚石中含有C—C键的个数为4NA
D.60gSiO2中含Si—O键的个数为2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】假如生长激素由两条多肽链组成,在生长激素的缩合过程中脱掉的水分子相对分子质量为3 384,已知20种氨基酸的平均分子质量为130,此蛋白质的分子量最接近于 ( )
A. 24 700 B. 21 316 C. 24 440 D. 440180
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com