
科目: 来源: 题型:
【题目】某烃的衍生物A,分子式为C6H12O2。实验表明A跟氢氧化钠溶液共热生成B和C,B跟盐酸反应生成有机物D,C在铜催化和加热条件下氧化为E,其中D、E都不能发生银镜反应。由此判断A的可能结构有
A.6种 B.4种 C.3种 D.2种
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酰氯(SO2Cl2)是一种重要的化工试剂,实验室利用SO2(g)和Cl2(g)合成硫酰氯的实验装置如下图所示(夹持装置已省略):

己知:①SO2(g)+Cl2(g)![]() SO2Cl2(I) ΔH=-97kJ/mol;
SO2Cl2(I) ΔH=-97kJ/mol;
②硫酰氯常温下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中易“发烟”;
③100℃以上或长时间存放硫酰氯都易分解,生成二氧化硫和氯气
回答下列问题:
(1)装置H的名称是_______________,装置E中活性炭的作用是 _____________。
(2)请指出下列装置中应盛入的试剂:B_____________、F________________。
(3)若采用实验室制法制取Cl2,其发生装置应选择_________装置 (用A、B、C等编号填空〉,其中发生反应的离子方程式为____________________。
(4)为什么硫酰氯在潮湿空气中易“发烟”____________ (结合化学方程式说明)。
(5)为了使通入反应器的SO2和Cl2达到最佳反应比例,可观察_________(填现象)来反映通入气体的速率,利用反应液的滴加快慢对气体通入速率加以控制。
(6)该装置尚存在明显的缺陷,请指出_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】丙烷是一种常见燃料,下列有关丙烷的叙述中不正确的是( )
A. 分子中碳原子不在一条直线上 B. 光照下能够发生取代反应
C. 比丁烷更易液化 D. 是石油分馏的一种产品
查看答案和解析>>
科目: 来源: 题型:
【题目】碳酸锰(MnCO3)是制造电信器材的软磁铁氧体,也用作脱硫的催化剂,瓷釉、涂料和清漆的颜料。工业上利用软锰矿(主要成分是MnO2,还含有Fe2O3、CaCO3、CuO等杂质)制取碳酸锰的流程如下图所示:
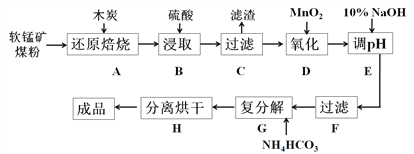
已知:还原焙烧主反应为:2MnO2+C![]() 2MnO+CO2↑。
2MnO+CO2↑。
可能用到的数据如下:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Mn(OH)2 |
开始沉淀pH | 1.5 | 6.5 | 4.2 | 8.3 |
沉淀完全pH | 3.7 | 9.7 | 7.4 | 9.8 |
根据要求回答下列问题:
(1)在实验室进行步骤A,需要用到的仪器为________________,步骤B中若采用质量分数为35%的硫酸(密度ρ=1.26 g/cm3),则其物质的量浓度为_________。
(2)步骤C中得到的滤渣主要成分是_______________,步骤D中还原剂与氧化剂的物质的量之比为__________。
(3)步骤E中调节pH的范围为________,其目的是_____________________________。
(4)步骤G的离子方程式为___________________,若Mn2+沉淀完全时测得溶液中CO32-的浓度为2.2×10-6 mol/L,则Ksp(MnCO3)=__________。
(5)实验室可以用Na2S2O8溶液来检验Mn2+是否完全发生反应,原理为:
Mn2++S2O82-+H2O=H++SO42-+MnO4-,
①请配平上述离子方程式____________________________;
②确认Mn2+离子已经完全反应的现象是_______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某烃的结构简式为![]() ,它可能具有的性质是
,它可能具有的性质是
A. 它能使溴水褪色,但不能使酸性高锰酸钾溶液褪色
B. 它既能使溴水褪色,也能使酸性高锰酸钾溶液褪色
C. 易溶于水,也易溶于有机溶剂
D. 能发生加成反应,一定条件下最多可与三倍物质的量的氢气加成
查看答案和解析>>
科目: 来源: 题型:
【题目】镓(Ga)与铝位于同一主族,金属镓的熔点是29. 8℃,沸点是2403℃,是一种广泛用于电子工业和通讯领域的重要金属。
(1)工业上利用镓与NH3在1000℃高温下合成固体半导体材料氮化镓(GaN),同时生成氢气,每生成lmol H2时放出10.27 kJ热量。
写出该反应.的热化学方程式___________________。
(2)在密闭容器中,充入一定量的Ga与NH3发生反应,实验测得反应平衡体系中NH3的体积分数与压强P和温度T的关系曲线如图1所示。

①图1中A点和C点化学平衡常数的大小关系是:KA_____ KC,(填“<”“=”或“>”),理由是____________。
②在T1和P6条件下反应至3min时达到平衡,此时改变条件并于D点处重新达到平衡,H2的浓度随反应时间的变化趋势如图2所示(34 min的浓度变化未表示出来),则改变的条件为________(仅改变温度或压强中的一种)。
(3)气相平衡中用组份的平衡分压(PB)代替物质的量浓度(cB)也可以表示平衡常数(记作Kp),用含P6的式子表示B点的Kp=_____________。
(4)电解精炼法提纯嫁的具体原理如下:以粗镓(含Zn、Fe、Cu杂质)为阳极,以高纯镓为阴极,以NaOH溶液为电解质,在电流作用下使粗镓溶解进入电解质溶液,并通过某种离子迁移技术到达阴极并在阴极放电析出高纯镓。
①已知离子氧化性顺序为:Zn2+3+2+2+。电解精炼镓时阳极泥的成分是________________。
②镓在阳极溶解生成的Ga3+与.NaOH溶液反应生成GaO2-,该反应的离子方程式为_________________;
GaO2-在阴极放电的电极反应式是________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】以菱镁矿(主要成分为MgCO3、含少量FeCO3、SiO2)制备高纯氧化镁的流程如下图所示:
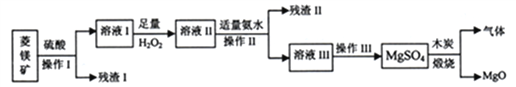
己知:25℃时,指示剂变色pH范围和几种氢氧化物的ksp及pH的关系如下表:
指示剂 | 酚酞 | 甲基酸 |
变色范围(pH) | 8.2-10.0 | 3.1-4.4 |
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 |
开始沉淀时pH | 1.1 | 5.9 | 8.4 |
沉淀完全时pH | 3.7 | 9.6 | 10.2 |
溶度积常数 | 4×10-34 | 8×10-16 | 2×10-13 |
(1)操作II和III中涉及的分离方法分别是____________、_______________。
(2)残渣I的主要成分是____________,加入H2O2的过程中可观察到的现象是___________,其中发生的离子反应方程式是_________________________。
(3)MgSO4和木炭在800℃煅烧时,只生成MgO和两种气体,将混合气体通入NaOH溶液时,气体被完全吸收。煅烧时发生反应的化学方程式是_____________。
(4)采用滴定法测定溶液II与加入氨水的最佳体积比,可以减少氨水的消粍和Mg2+的损失。实验中应选取_______________指示剂,加入氨水是为了沉淀溶液II中的___________离子,若终点时该离子浓度=1.0×10-5mol·L-1,则溶液III的pH=_____________(己知:lg2=0.3)。
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物A是聚合反应生产胶黏剂基料的单体,亦可作为合成调香剂I、聚酯材料J的原料,相关合成路线如下:
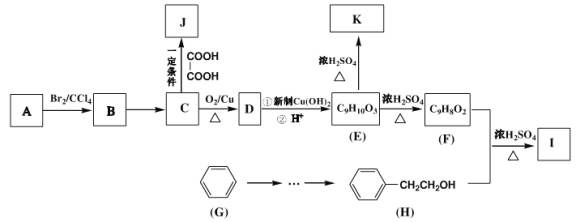
已知:在质谱图中烃A的最大质荷比为118,其苯环上的一氯代物共三种,核磁共振氢谱显
示峰面积比为3:2:2:2:1。
根据以上信息回答下列问题:
(1)A的官能团名称为__________________,B→C的反应条件为_____________,E→F的反应类型为_____________。
(2)I的结构简式为____________________,若K分子中含有三个六元环状结构,则其分子式为________________。
(3)D与新制氢氧化铜悬浊液反应的离子方程式为_______________________________。
(4)H的同分异构体W能与浓溴水反应产生白色沉淀,1 mol W参与反应最多消耗3 mol Br2,请写出所有符合条件的W的结构简式___________________________________。
(5)J是一种高分子化合物,则由C生成J的化学方程式为
______________________________________________________________________。
(6)![]() 已知:
已知:![]() (R为烃基)
(R为烃基)
设计以苯和乙烯为起始原料制备H的合成路线(无机试剂任选)。
[合成路线示例:]![]()
_____________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】亚硝酰氯(NOCl)是一种黄色气体,熔点为-64.5 ℃,沸点为-5.5 ℃,遇水易水解,可用于合成清洁剂、触媒剂等。实验室可由氯气与一氧化氮在常温常压下制备亚硝酰氯。某同学利用纯净的NO和Cl2制备NOCl,装置如下图所示。(已知:Cl2的熔点为-101 ℃,沸点为-34 ℃;NO的熔点为-163.6 ℃,沸点为-151 ℃)
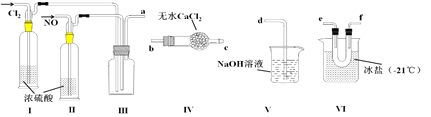
(1)装置连接顺序为a→_______________________(按气流方向,用小写字母表示)。
(2)装置I和II除可进一步干燥NO和Cl2外,另一个作用是____________________。
(3)装置IV的作用是_________________________________,当使用该装置干燥气体时,通常是b口进气,c口出气,原因是__________________________________。
(4)装置V中吸收尾气时,NOCl发生反应的化学方程式为_________________________。
(5)在实际实验操作中,Cl2和NO通入比例略大于1:2,这样做的原因是_________________。
(6)已知王水是浓硝酸与浓盐酸的混酸,一定条件下该混酸可生成亚硝酰氯和一种常见有色气体,该反应的化学方程式为____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com