
科目: 来源: 题型:
【题目】下列各变化中属于原电池反应的( )
A. 在空气中金属铝表面迅速氧化形成保护层
B. 锌与稀硫酸反应时,用锌粉代替锌块可使反应加快
C. 红热的铁丝与冷水接触,表面形成蓝黑色保护层
D. 镀锌铁表面有划损时,仍然能阻止铁被氧化
查看答案和解析>>
科目: 来源: 题型:
【题目】1,4-二苯基丁烷是用来研究聚合物溶剂体系热力学性质的重要物质,工业上用下列方法制备1, 4-二苯基丁烷。(格拉泽反应:2R-C≡C-H![]() R-C≡C-C≡C-R+H2)
R-C≡C-C≡C-R+H2)
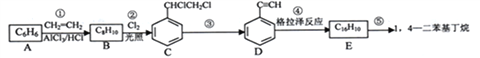
回答下列问题:
(1)②和⑤的反应类型分别为__________________、____________。
(2)反应③由C生成D的条件是_____________________。
(3)E的结构简式为___________,该分子中位于同一直线上的原子最多是___________个。
(4)反应①的化学方程式是___________。
(5)C与足量氢氧化钠水溶液反应可制得化合物F,F的分子式是__________,同时符合下列条件的F的同分异构体有_____________种(不含立体异构)。
①1mol该异构体最多能与2mol NaOH溶液反应
②该异构体的核磁共振氢谱显示为3组峰,且峰面枳之比为1:1:3
查看答案和解析>>
科目: 来源: 题型:
【题目】资料显示:O2的氧化性随溶液pH的增大逐渐减弱。室温下,某学习小组利用下图装置探究不同条件下KI与O2的反应,实验记录如下。
序号 | 烧杯中的液体 | 5分钟后现象 |
① | 2 mL 1mol·L-1KI溶液+5滴淀粉 | 无明显变化 |
② | 2 mL1 mol·L-1KI 溶液+5 滴淀粉+2mL0. 2 mol·L-1HC1 | 溶液变蓝 |
③ | 2mLl mol·L-1KI溶液+5滴淀粉+ 2mL0.2 mol·L-1KC1 | 无明显变化 |
④ | 2mL1 mol·L-1KI溶液+5滴淀粉+2 mL0. 2 mol·L-1CH3COOH | 溶液变蓝,颜色 较②浅 |
回答下列问题:
(1)实验③的目的是__________________。
(2)实验②中发生反应的离子方程式是_____________________。
(3)实验②比实验④溶液颜色深的原因是___________________。
为进一步探究KI与O2的反应,用上述装置继续进行实验:
序号 | 烧杯中的液体 | 5小时后现象 |
⑤ | 2mL混有KOH的pH=8.5的lmol·L-1 KI溶液+5滴淀粉 | 溶液略变蓝 |
⑥ | 2mL混有KOH的pH=10的lmol L-1KI溶液+5滴淀粉 | 无明显变化 |
对于实验⑥的现象。甲同学猜想“pH = 10时O2不能氧化I-”,他设计了下列装置进行实验以验证猜想。
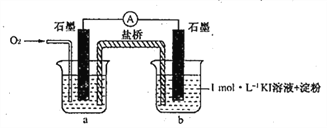
(4)烧杯a中的溶液为________________。
(5)实验结果表明此猜想不成立。支持该结论的实验现象是:通入O2后,_____________。
(6)乙同学向pH = 10的“KOH一淀粉溶液”中滴加碘水,溶液先变蓝后迅速褪色,经检测褪色后的溶液中含有IO3- ,用离子方程式表示退色的原因是___________________。
(7)该小组同学对实验过程进行了整体反思,推测实验①和实验⑥的现象产生的原因分别可能是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某课外小组设计的实验室制取乙酸乙酯的装置如下图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸,D中放有饱和碳酸钠溶液。
已知:①无水氯化钙可与乙醇形成难溶于水的 CaCl2·6C2H5OH;
②有关有机物的沸点如下:
乙醚34.7℃ 乙醇78.5℃ 乙酸1181℃ 乙酸乙酯77.1℃
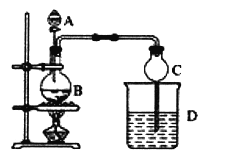
请回答下列问题:
(1)仪器A的名称___________,浓硫酸的作用为____________;
(2)球形干燥管C的作用是___________________;
(3)若参加反应的乙醇为CH3CH2l8OH,请写出用该乙醇制备乙酸乙酯的化学方程式______________;
(4)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水。若将其净化提纯,常先加入无水氯化钙,分离出_________;再加入_________(此空从下列选项中选择①碱石灰、②生石灰、③无水硫酸钠);然后进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯。
查看答案和解析>>
科目: 来源: 题型:
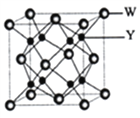
【题目】有X、Y、Z、W、A、B六种元素。其相关信息如下:
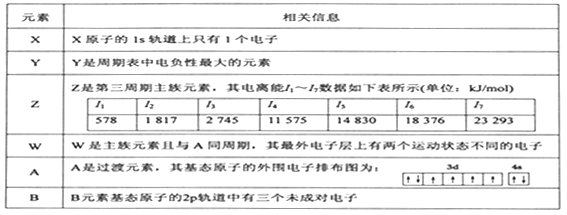
请回答下列有关问题:
(1)根据信息分析元素Y是________ (填元素符号),A在元素周期表中的位置是________。
(2)BX3分子的中心原子采取的杂化类型是_____________。
(3)光谱证实单质 Z与强碱溶液反应生成[Z(OH)4]-,该原子的空间构型是_________,[Z(OH)4]-离子中存在的化学键有_____________(填字母)
A.极性共价键 B.非极性共价键 C.配位键 D. σ键 E. π键
(4)Y与W可形成离子化合物,其晶胞结构如下图所示。W离子采取的堆枳方式是_________, W离子的配位数为__________,W离子的配位数为_______,Y离子占据空位(填“四面体或八面体”)。若该晶体的密度为dg·cm-3,则该晶胞中最近的Y离子与W离子间的距离是______cm,(设NA为阿佛加德罗常数的值,只需列出计算表达式〉
查看答案和解析>>
科目: 来源: 题型:
【题目】下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的KI溶液、足量的CuSO4溶液和K2SO4溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙中c电极质量增加32 g。据此回答问题: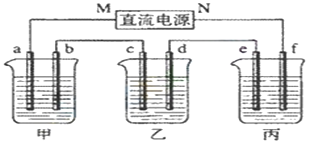
(1) 电源的N端为_________极;
(2) 电极b上发生的电极反应为____________________________________________;
(3) 电极f上生成的气体在标准状况下的体积_________________________________;
(4) 电解开始时,在甲烧杯的中央,滴几滴淀粉溶液,你能观察到的现象是______________;
(5) 电解前后溶液的pH变化情况,(填增大、减小或不变)甲溶液___________;乙溶液_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】完成下列填空:
(1)写出氯化钠的电子式_______________,氮气的结构式______________;
(2)用离子方程式表示氨水溶液显碱性的原因_________________;
用离子方程式表示碳酸钠溶液显碱性的原因_____________________;
(3)某碳氢化合物的相对分子质量为72,且一个分子结构中有3个甲基,则该有机物的结构简式为____________,该有机物的系统命名是_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】I、依据事实,写出下列反应的热化学方程式。
(1)在25 ℃、101 kPa下,1 g甲烷燃烧生成CO2和液态水时放热55.625 kJ。则表示甲烷燃烧热的热化学方程式为________________________。
(2)若适量的N2和O2完全反应,每生成23 g NO2需要吸收16.95 kJ热量,则表示该反应的热化学方程式为______________。
(3)在25 ℃、101 kPa条件下,C(s)、H2(g)、CH3COOH(1)的燃烧热分别为393.5 kJ/mol、285.8 kJ/mol、870.3 kJ/mol,则2C(s)+2H2(g)+O2(g)===CH3COOH(1)的反应热ΔH为________。
II、锌锰干电池是应用最普遍的电池之一。其基本反应为:
X极:Zn-2e-===Zn2+
Y极:2MnO2+2NH![]() +2e-===Mn2O3+2NH3+H2O
+2e-===Mn2O3+2NH3+H2O
(1)X是电池的________(填“正”或“负”,下同)极,Y是电池的________极。
(2)该电池总反应的离子方程式为:_______________________。
(3)若反应消耗16.25gZn,则电池中转移电子的物质的量为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. 化学反应一定伴随着物质变化和能量变化 B. 化合反应都是放热反应
C. 绿色新能源是目前能源的主要形态 D. 生物质能是不可再生能源
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com