
科目: 来源: 题型:
【题目】据报道:研究人员破解了北京及华北地区雾霾主要成分硫酸盐的形成之谜,发现在大气细颗粒物吸附的水分中NO2与SO2的化学反应是当前雾霾期间硫酸盐的主要生成路径。某实验小组对NO2和SO2的反应进行探究。
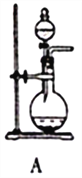
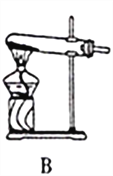

图Ⅰ 图Ⅱ
(1)SO2的发生装置可以选择图Ⅰ中的_______(填字母),反应的化学方程式为___________________。
(2)按图Ⅱ所示进行实验。
①实验时往集气瓶中通入等体积的SO2和NO2,观察到集气瓶中有白烟产生,通入的NO2气体颜色变浅,该反应的化学方程式为______________________。如果集气瓶中有少量水,则可能观察不到白烟,其原因是____________。
②请指出图Ⅱ装置设计的不合理之处___________。
(3)硫酸铵是我国pm2.5雾霾的主要成分,收集一定量的雾霾固体进行验证:
操作步骤 | 实验现象 | 结论 |
取一定量的雾霾固体于试管中,加入适量的水溶解,把溶液分成两份。 | ||
一份___________。 | 有白色沉淀生成。 | 证明雾霾固体中含有SO42- |
另一份___________。 | ___________。 | 证明雾霾固体中含有NH4+。综合上面实验,说明雾霾固体颗粒中含有(NH4)2SO4。 |
查看答案和解析>>
科目: 来源: 题型:
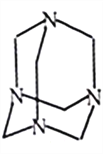
【题目】(1)盐酸中加入六次甲基四胺对钢铁有一定缓蚀作用,右图为其结构简式,其分子式为(CH2)6N4,其中碳原子采用___________杂化,其缓蚀作用是因为分子中___________原子的孤对电子能与铁原子形成配位键,覆盖在钢铁表面。
(2)CO与N2属于等电子体,1个CO分子中含有的π键数目是___________个。
C、N、O三种元素的笫一电离能最大的是___________。
(3)右图是某化合物的晶胞示意图,硅原子与铝原子之间都以共价键连接。
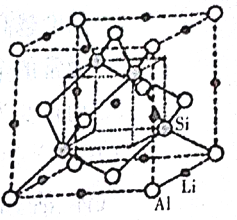
①该化合物的化学式是___________。
②Si元素基态原子的电子排布式是___________。
③已知晶胞边长为5.93×10-8cm,Si与A1之间的共价键键长是___________cm(只要求列算式,不必计算出数值,下同),晶体的密度是___________g·cm-3
查看答案和解析>>
科目: 来源: 题型:
【题目】在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2 L的密闭容器中发生反应:N2O4(g)![]() 2NO2(g) ΔH>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如图所示。
2NO2(g) ΔH>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如图所示。

(1)该温度下,该反应的平衡常数为___________,若温度升高,K值将________(填“增大”、“减小”或“不变”)。
(2)a、b、c、d四个点中,表示化学反应处于平衡状态的是________点。从起点开始首次达到平衡时,以NO2表示的反应速率为________。
(3)25 min时,加入了________(填加入物质的化学式及加入的物质的量),使平衡发生了移动。
(4)d点对应NO2的物质的量浓度_______(填“大于”、“小于”或“等于”)0.8 mol·L-1,理由是__________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】25 ℃时,向盛有50 mL pH=2的一元酸HA溶液的绝热容器中加入pH=13的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示。下列叙述正确的是
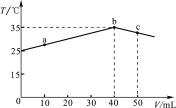
A. a→b的过程中,溶液中c(A-)与c(HA)之和始终不变
B. c点表示酸碱恰好完全反应
C. 等浓度的NaOH和NaA混合溶液中一定存在关系:c(Na+)>c(A-)>c(OH-)>c(H+)
D. 25 ℃时,HA的电离平衡常数Ka约为1.43×10-3
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于丙烯(CH2=CH—CH3)的叙述中不正确的是
A. 分子中含有碳碳双键容易断裂,化学性质活泼
B. 能使酸性高锰酸钾溶液褪色
C. 在空气中能燃烧生成二氧化碳和水
D. 同质量的丙烯和乙烯完全燃烧生成水的质量不同
查看答案和解析>>
科目: 来源: 题型:
【题目】一定量的混合气体在密闭容器中发生如下反应:mA(g)+nB(g)![]() pC(g)+qD(g),达到平衡后,温度不变,将气体体积缩小到原来的一半,当达到新平衡时,C的浓度由0.15 mol·L-1变为原来的0.20mol·L-1,则下列叙述正确的是
pC(g)+qD(g),达到平衡后,温度不变,将气体体积缩小到原来的一半,当达到新平衡时,C的浓度由0.15 mol·L-1变为原来的0.20mol·L-1,则下列叙述正确的是
A. m+n>p+q B. m+n<p+q
C. 平衡向正反应方向移动 D. C的体积分数增大
查看答案和解析>>
科目: 来源: 题型:
【题目】镁带在盐酸中反成,产生H2的速率(v)与时间(t)的关系如下图所示。
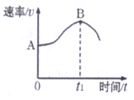
(1)写出该反应的离子方程式____________________。
(2)下列变化:①H+的浓度②镁带的表面积③溶液的温度④Cl-的浓度,不能影响该反应速率的有_________(填写选项的序号)。
(3)0~t1,时间段速率逐渐加快的主要原因是___________。
(4)t1时刻后反应速率变慢的主要原因是___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】可逆反应N2(g)+3H2(g)![]() 2NH3(g)在密闭容器中进行,一段时间后测得c(N2)=1.5 mol/L,c(H2)=0.6 mol/L,c(NH3)=1.5 mol/L,则此反应达到平衡后,下列数据可能正确的是
2NH3(g)在密闭容器中进行,一段时间后测得c(N2)=1.5 mol/L,c(H2)=0.6 mol/L,c(NH3)=1.5 mol/L,则此反应达到平衡后,下列数据可能正确的是
A. c(N2)=2.25 mol/L B. c(NH3)=1.9 mol/L
C. c(H2)=0.3 mol/L D. c(N2)=1.3mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分,请回答有关问题:
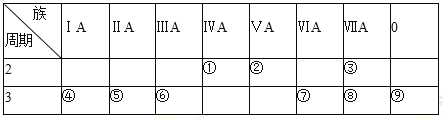
(1)①的元素符号为 _________;⑨的原子结构示意图为 _________。
(2)第3周期主族元素中,原子半径最小的是_________(用元素符号表示)。
(3)表中元素的气态氢化物中最稳定的是_____________________(用化学式表示)。
(4)①、②、⑦、⑧四种元素的最高价氧化物的水化物中酸性最强的是_________(用化学式表示)。
(5)⑤、⑥两种元素相比较,金属性较强的是_________(填元素名称),可以验证这一结论的实验是_________(填正确选项的编号)。
A.将在空气中放置已久的这两种元素的块状单质分別放入NaOH溶液中,比较反应的剧烈程度
B.将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应,比较反应的剧烈程度
C.将形状,大小相同的这两种元素的单质分别和热水作用,并滴入酚酞试液,比较反应的剧烈程度
(6)④和⑥两种元素的最高价氧化物的水化物在水溶液中反应的离子方程式为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】关于材料的下列说法中正确的是
A. 废旧轮胎均可直接在室外焚烧处理
B. 具有网状结构的酚醛树脂可溶于酒精
C. 复合材料玻璃钢具有强度高、质量轻等优点
D. 合成纤维、人造纤维和光导纤维均为有机高分子材料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com