
科目: 来源: 题型:
【题目】我们利用物质的结构与性质对周期表进行研究,有助于我们更好地掌握同类知识。
(1)基态砷原子中,价电子占用_________个原子轨道;雌黄分子式为As2S3,分子结构如图,则As原子的杂化方式为_________ 。
(2)N2与CO互为等电子体,则1molCO分子中含有的π键数目是_________个。
(3)向CuSO4溶液中加人少量氨水生成蓝色沉淀,继续加人过量氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加人一定量乙醇,析出[Cu(NH3)4]SO4 .H2O晶体;该晶体所含的非金厲元素中,N、O、S第一电离能由大到小的顺序是_________ (填元素符号),SO42-的空间构型为____________,晶体中含有的化学键有__________。加人乙醇后析出[Cu(NH3)4]SO4 .H2O晶体的原因是____________。
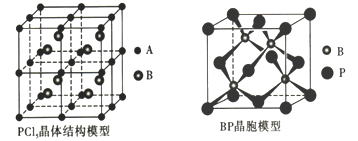
(4)常温下PCl5是一种白色晶体,其立方晶系晶体结构模型如下左图所示,由A、B两种微粒构成。 将其加热至148℃熔化,形成一种能导电的熔体。已知A微粒与CCl4具有相同的空间构型和相似的化学键特征,则A为_________ , B为_______________。
(5)磷化硼(BP)是一种超硬耐磨涂层材料,下右图为其立方晶胞。已知晶体中最近的硼原子和磷原子核间距为x cm,磷化硼的摩尔质量为bg.·mol-1,阿伏加德罗常数为NA,则磷化硼晶体密度的表达式
为____________g.cm-3。(列出计算式即可)
查看答案和解析>>
科目: 来源: 题型:
【题目】【物质结构与性质】A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是____(填元素符号),其中C原子的核外电子排布式为______________;
(2)单质A有两种同素异形体,其中沸点高的是___________(填分子式),原因是_________________;A和B的氢化物所属的晶体类型分为______________和______________;
(3)C和D反应可生成组成比1:3的化合物E,E的立体构型为________________,中心原子的杂化轨道类型___________________;
(4)化合物D2A的立体构型为______________,中心原子的价层电子对数为_______________,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为_____________________;
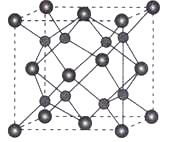
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566nm,F的化学式为_________,晶胞中A原子的配位数为__________,列式计算晶体F的密度_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在给定条件下,下列离子组的离子共存判断及反应的离子方程式均正确的是
选项 | 条件 | 离子组 | 离子共存判断及的离子方程式 |
A |
| Fe2+、NO3-、Al3+、Cl- | 不能大量共存, 3Fe2++4H++NO3-=3Fe3++NO+2H2O |
B | 由水电离出c(H+) =1×10-13mol·L-1 | K+、NH4+、Cl-、AlO2- | 能大量共存 |
C | 含有大量Al3+的溶液 | Na+、NH4+、SO42-、Cl- | 能大量共存 |
D | 通入少量SO2气体 | K+、Na+、ClO-、SO42- | 不能大量共存, 2ClO-+SO2+H2O=2HClO+SO32- |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应中,最终一定有白色沉淀生成的是( )
①向AlCl3溶液中加入过量的氨水②向Na2SiO3溶液中通入过量的CO2;
③向Ca(OH)2溶液中通入过量CO2;④向CaCl2溶液中通入少量的CO2
A. ①② B. ①③④ C. ①④ D. ②③④
查看答案和解析>>
科目: 来源: 题型:
【题目】砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)写出基态As原子的核外电子排布式________________________。
(2)根据元素周期律,原子半径Ga_____________As,第一电离能Ga____________As。(填“大于”或“小于”)
(3)AsCl3分子的立体构型为____________________,其中As的杂化轨道类型为_________。
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是_____________________。
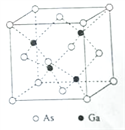
(5)GaAs的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如图所示。该晶体的类型为________________,Ga与As以________键键合。Ga和As的摩尔质量分别为MGa g·mol-1和MAs g·mol-1,原子半径分别为rGa pm和rAs pm,阿伏伽德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图表示常见元素单质及化合物相应转化关系,部分反应的产物没有全部列出。
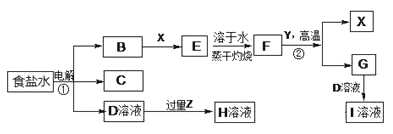
已知:B是黄绿色气体、有毒性,C是所有气体中密度最小的一种,D是一种强碱;X、Y是日常生活中应用最为广泛的两种金属材料,F是一种红棕色的固体氧化物,常可以用作制备红色油漆和涂料;Z为气态氧化物。
请回答下列问题:
(1)气体B和X反应的化学方程式___________;
(2)反应②属于四种基本反应类型中的_______反应。
(3)有学生认为B与X反应的产物E不一定是纯净物。他认为产物中可能还有______(填化学式),为验证其猜想该同学设计了相关实验,你认为他需要选择的试剂为____。
A.酸性高锰酸钾溶液 B.NaOH溶液 C.KSCN溶液 D.稀硫酸
(4)若Z能导致温室效应,则反应③的离子反应方程式为_______________。
(5)若Z是酸雨形成的罪魁祸首,目前应用最广泛的工业处理含Z废气的方法是在一定条件下与生石灰作用而使其固定,产物可作建筑材料,反应的化学方程式为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2。下列关于该装置的四种说法,正确的组合是
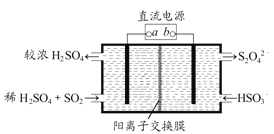
①.a为直流电源的负极
②.阴极的电极反应式为:2HSO3-+2H++2e-=S2O42-+2H2O
③.阳极的电极反应式为:SO2+2H2O-2e-=SO42-+4H+
④.电解时,H+由阴极室通过阳离子交换膜到阳极室
A. ①和② B. ①和③
C. ②和③ D. ③和④
查看答案和解析>>
科目: 来源: 题型:
【题目】下列变化不能通过一步反应直接完成的是( )
A. Al→Al3+ B. Al→ [Al(OH)4]-
C. Al2O3 →Al(OH)3 D. Al2O3 →[Al(OH)4]-
查看答案和解析>>
科目: 来源: 题型:
【题目】下表为元素周期表的一部分,参照元素①~⑨在表中的位置,按要求回答下列问题:
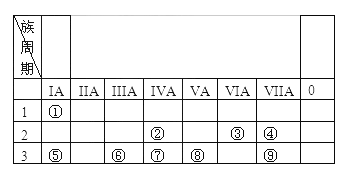
(1)在元素①~⑨,最活泼的金属元素是_______(填元素名称);最活泼的非金属元素名称是_____(填元素名称)。元素⑨的原子结构示意图_______。
(2)用电子式表示元素②与③形成的原子个数比为1:2的共价化合物________。
(3)⑤、⑥、⑦三种元素的原子半径由大到小的顺序是__________(用元素符号表示)。
(4)元素④和⑨所能形成的气态氧化物的稳定性______大于______(化学式表示);元素⑦、⑧、⑨的最高价氧化物对应的水化物的酸性由强到弱的顺序_______(化学式表示)。
(5)写出元素⑤和⑥的最高价氧化物的水化物相互反应的离子方程式:__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com