
科目: 来源: 题型:
【题目】设NA表示阿伏加徳罗常数的值。下列说法中不正确的是
A. 0.1mol-NH2(氨基)中所含有的电子数为0.9NA
B. lmol D218O所含的中子数为12NA
C. 14 g聚乙烯与聚丙烯的混合物中含H原子的数目为2NA
D. —定条件下,0.2 mol SO2与足量O2充分反应,生成的SO3分子数为0.2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式或电离方程式的书写正确的是()
A. NaHSO4熔融:NaHSO4=Na++HSO4-
B. Al(OH)3酸式电离: Al(OH)3= H++AlO2- + H2O
C. 向Na2S溶液中滴入少量稀盐酸:S 2-+2H+=H2S↑
D. Ca(HCO3)2溶液与过量NaOH溶液反应:OH-+HCO![]() +Ca2+=CaCO3↓+H2O
+Ca2+=CaCO3↓+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液中可能含有H+、Na+、NH4+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示,下列说法不正确的是( )
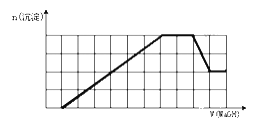
A. 原溶液中一定含有的阳离子是H+、NH4+、Fe3+、Al3+
B. 原溶液中一定含有SO42-
C. 原溶液中含有的Fe3+和Al3+的物质的量之比为1:1
D. 反应最后形成的溶液中溶质为Na2SO4
查看答案和解析>>
科目: 来源: 题型:
【题目】第三周期的元素单质及其化合物有广泛的用途,请根据相关知识回答下列问题:
(1)原子最外层电子数是核外电子总数![]() 的元素,其原子结构示意图为________________;还原性最弱的简单阴离子__________ (填离子符号)。
的元素,其原子结构示意图为________________;还原性最弱的简单阴离子__________ (填离子符号)。
(2)晶体硅(熔点1410℃)是良好的半导体材料,可通过如图所示过程制备:
![]()
在上述由SiCl4制纯硅的反应中, 测得每生成2.8kg纯硅需要吸收akJ热量,请写出该反应的热化学方程式___________________。
(3)氯化铝的水溶液可用于净水,其原因是_________ (用离子方程式表示)。
工业上用铝土矿(主要成分为Al2O3,含有Fe2O3、SiO2等杂质)来制取无水氯化铝的一种工艺流程如图所示:

已知:
物质 | SiCl4 | AlCl3 | FeCl3 | FeCl2 | Al2O3 | Fe2O3 | SiO2 |
沸点/℃ | 57.6 | 180(升华) | 300(升华) | 1023 | 2980 | 3414 | 2230 |
①工业制铝时,电解Al2O3而不电解AlCl3的理由是____________。
② 步骤Ⅰ中焙烧使固体水分挥发、气孔数目增多, 其作用是_________ (只要求写出一种)。
③步骤Ⅱ中若不通入氯气和氧气,则生成相对原子质量比硅大的单质______________。
④尾气经冷却至室温后用足量的KOH浓溶液吸收,生成的盐中除了K2CO3外,还有3种,其化学式分别为________________;其中一种盐可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式:________________。
⑤结合流程及相关数据分析,步骤V中加入铝粉的目的是__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】燃烧法是测定有机化合物分子式的一种重要方法。在一定温度下取3.0g某有机物在足量的O2中完全燃烧,产物仅为CO2和水蒸气。将生成物依次用浓硫酸和碱石灰充分吸收,浓硫酸增重1.8g,碱石灰增重4.4g。
(1)通过计算确定该有机物的最简式________(写出计算过程)。
(2)若该有机物能与NaHCO3溶液反应生成气体,且在符合要求的有机物中相对分子质量最小,其结构简式为_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】按如图所示装置进行实验,以制取乙酸乙酯。
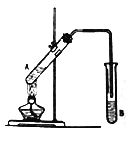
(1)试管A中的液体由以下试剂混合而成:①2mL乙醇;②3mL浓硫酸;③2mL 乙酸。一般况下,这三种试剂的加入顺序是:先加入________(填序号,下同),再加入_________,最后加入③。
(2)为防止试管A中的液体在实验时发生暴沸,在加热前还应加入碎瓷片。若加热后发现未加入碎瓷片,应采取的补救措施是:_________________________________________________________。
(3)试管B中盛放的试剂是___________________;反应结束后,分离B中的液体混合物需要用到的玻璃仪器主要是_____________。试管B中的导管末端不伸入液面下方的目的是_______________。
(4)试管 A中CH3COOH与C2H518OH反应的化学方程式为:___________________________________。
(5)该实验中用30gCH3COOH与46gC2H5OH反应,如果实际得到的乙酸乙酯的质量是26.4g,该实验中乙酸乙酯的产率是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学小组的同学为探究原电池原理,设计如图所示装置,将锌、铜通过导线相连,置于稀硫酸中。
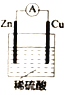
(1)锌片上的电极反应式为__________________。
(2)铜片上的现象是__________________。
(3)若反应过程中有0.2 mol电子发生转移,则生成的气体在标准状况下的体积为______________。
(4)该小组同学将稀硫酸分别换成下列试剂,电流计仍会偏转的是_________(填序号)。
A.无水乙醇 B.醋酸溶液 C.CuSO4溶液 D.苯
(5)实验后同学们经过充分讨论,认为符合某些要求的化学反应都可以通过原电池来实现。下列反应可以设计成原电池的是________(填字母代号)。
A. NaOH+HCl= NaCl+H2O B. 2H2+O2=2H2O
C. Fe+2FeCl3=3FeCl2 D. 2H2O=2H2↑+2O2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】对剧毒的氰化物可在碱性条件下用如下方法进行处理:2CN—+8OH—+5Cl2 = 2CO2+N2+10Cl—+4H2O。下列判断正确的是 ( )
A. 当有0.2mol CO2生成时,溶液中阴离子的物质的量增加![]()
B. 该反应中,每有2molCN—反应,转移电子为![]()
C. 上述反应中的还原剂是![]()
D. 还原性:Cl—>CN—
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com