
科目: 来源: 题型:
【题目】一定量的CH4在恒压密闭容器中发生反应:CH4(g)![]() C(s) + 2H2(g)。平衡时,体系中各气体体积分数与温度的关系如图所示:
C(s) + 2H2(g)。平衡时,体系中各气体体积分数与温度的关系如图所示:
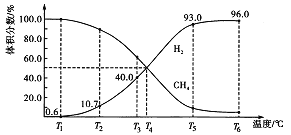
(1)已知甲烷、碳、氢气的燃烧热分别为890.31kJ/mol、395.00kJ/mol、285.80kJ/mol,则该反应的反应热△H=__________。
(2)下列能说明反应一定达到平衡状态的是_______。
a.H2和CH4的体积分数相等 b.混合气体的平均相对分子质量不变
c.混合气体的密度不变 d.气体总压强不再变化
e.碳的质量不再改变
(3)T2℃时,若在平衡体系中充入惰性气体,此时反应速率________(填“变大”、“变小”或“不变”),且v正_______v逆(填“>”、“<”或“=”)。
(4)T4℃时,若在平衡体系中充入等体积的H2和CH4,则平衡_____移动,其理由是_______。
(5)T3℃时,反应达平衡后CH4的转化率为____________。
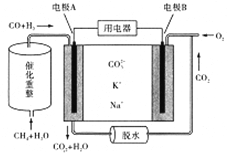
(6)CH4能催化重整转化为CO和H2,下图是一种熔融碳酸盐燃料电池示意图,电极A上CO参与电极反应方程式为____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,把3.0molM和2.5mol N混合于2.0L的密闭容器中,发生反应的化学方程式为:3M(g)+N(g) ![]() XP(g)+2Q(g) ,5min后反应达到平衡,容器内的压强变小,己知Q的平均反应速率为0.01mol·L-1·min-1,下列说法错误的是( )
XP(g)+2Q(g) ,5min后反应达到平衡,容器内的压强变小,己知Q的平均反应速率为0.01mol·L-1·min-1,下列说法错误的是( )
A. X的值为1 B. M的平均反应速率为0.15 molL-1·min-1
C. M的转化率为60% D. 平衡时P的浓度为0.25 molL-1
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应中不能得到氢氧化铝沉淀的是 ( )
A. 硫酸铝溶液与过量的氨水混合B. 氯化铝溶液中加入几滴烧碱溶液
C. 偏铝酸钠溶液中加入过量的盐酸D. 偏铝酸钠溶液中通入过量的二氧化碳
查看答案和解析>>
科目: 来源: 题型:
【题目】NA为阿伏加德罗常数,下列说法正确的是 ( )
标准状况下,11.2L的戊烷所含的分子数为0.5NA
B.28g乙烯所含共用电子对数目为4NA
C.标准状况下,11.2 L二氯甲烷所含分子数为0.5 NA
D.现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
①二氧化硅是酸性氧化物,它可以跟碱反应,但不能与任何酸反应
②根据反应SiO2+CaCO3![]() CaSiO3+CO2↑可推知硅酸酸性比碳酸强
CaSiO3+CO2↑可推知硅酸酸性比碳酸强
③二氧化碳通入硅酸钠溶液中可以制得硅酸
④二氧化硅常被用来制造光导纤维
A. ①② B. ②③ C. ③④ D. ①④
查看答案和解析>>
科目: 来源: 题型:
【题目】重铬酸钾(K2Cr2O7)是一种常见的强氧化剂,能氧化硫酸亚铁、盐酸等物质。某兴趣小组模拟企业处理含铬废水(主要含Cr2O72-和Cr3+),同时获得重铬酸钾晶体的流程如下:
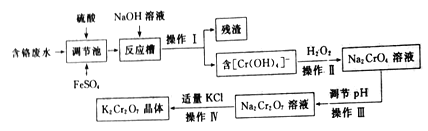
回答下列问题:
(1)操作I是______,残渣的主要成分是______。
(2)调节池中发生的主要反应的离子方程式为__________________。
(3)操作Ⅲ__________(填“能”或“不能”)用盐酸调节溶液pH,原因是___________。
(4)从Na2Cr2O7溶液中获得K2Cr2O7晶体的操作依次是加入适量KCl固体,搅拌、溶解,在水浴上加热浓缩至________时停止加热。接下来获得K2Cr2O7晶体需要的一系列操作中,下列仪器可能会用到的是__________(填标号)。

(5)为检测处理后废水是否达到排放标准,某同学进行了如下实验:取100mL处理后的废液样品于锥形瓶中,用浓醋酸调节pH=5并加入适量固体抗坏血酸,使Cr2O72-完全转化为Cr2+,再用cmol· L-1的EDTA(用H4Y表示)标准溶液进行滴定,其反应原理为:Cr3++Y4-=CrY-,若实验消耗EDTA标准溶液VmL,则处理后的废液中含铬元素浓度为______mg·L-1(用含c、V的式子表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】CoC2O4是制备金属钴的原料。利用含钴废料(主要成分为Co2O3,含少量Fe2O3、Al2O3、CaO、MgO、碳及有机物等)制取CoC2O4的工艺流程如下:
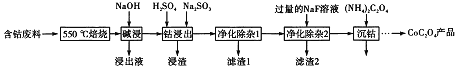
(1)“500℃煅烧”的目的是_______。
(2)“浸出液”的主要成分是_______。
(3)“钴浸出”过程中Co3+转化为Co2+,反应的离子方程式为_________。
(4)“净化除杂1”过程中,需在40~50℃ 加入H2O2溶液,其目的是_____________。
(用离子方程式表示);再升温至80~85℃,加入Na2CO3溶液,调pH至5,“滤渣I”的主要成分是___________。
(5)“净化除杂2”可将钙、镁离子转化为沉淀过滤除去,若所得滤液中c(Ca2+)=1.0×10-5mol/L,则c(Mg2+)为________[已知Ksp(MgF2)=7.35×10-11”、 Ksp(CaF2)=1.05×10-10]
(6)为测定制得的CoC2O4产品的纯度,现称取1.00g样品,将其用适当试剂转化为草酸铵[(NH4)2C2O4〕溶液,再用过量稀硫酸酸化,用0.1000mol/L高锰酸钾溶液滴定,当_________时,即达到滴定终点,共用去高锰酸钾溶液26.00mL,该产品的纯度为_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在工业上,通过含锌矿石制取应用广泛的锌及其化合物。
(1)Zn在元素周期表中位于_____区,其基态原子价电子排布式为________。
(2)[Zn(CN)4]2-常用于电镀工业中,其中配位原子基态时核外电子的轨道表示式为_____,与CN-互为等电子体的粒子有_____、________(写出两种)。
(3)[Zn(CN)4]2-在水溶液中与甲醛(HCHO)溶液反应可制得HOCH2CN。甲醛分子的立体构型为________.中心原子杂化方式为________;HOCH2CN中元素电负性由大到小的顺序_______,1 mol HOCH2CN分子中,含有σ键的数为_________。
(4)ZnS和HgS晶体在岩浆中先晶出的是________,其原因是___________。
(5)ZnO的一种晶体结构与金刚石类似,4 个锌原子占据金刚石中晶胞内四个碳原子的位置,则该氧化物的密度为______g/cm3(设晶胞参数为apm,NA表示阿伏伽德罗常数)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中不正确的是( )
A. 化石燃料在任何条件下都能充分燃烧
B. 化石燃料在燃烧过程中能产生污染环境的CO、SO2等有害气体
C. 直接燃烧煤不如将煤进行深加工后,再燃烧效果好
D. 固体煤变为气体燃料后,燃烧效率将更低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com