
科目: 来源: 题型:
【题目】下列说法正确的是
A.![]() 的系统命名法为2,5-二甲基-4-乙基己烷
的系统命名法为2,5-二甲基-4-乙基己烷
B.石油的裂化、煤的气化与液化都属于化学变化,而石油的分馏与煤的干馏都属于物理变化
C.总质量一定时,乙酸和葡萄糖无论以何种比例混合,完全燃烧消耗氧气的量相等
D.油脂、淀粉、蛋白质等高分子化合物都属于混合物,一定条件下均可发生水解
查看答案和解析>>
科目: 来源: 题型:
【题目】瑞巴匹特为新型抗溃疡药,它可保护胃肠黏膜免受各种致溃疡因子的危害,其合成路线如下:
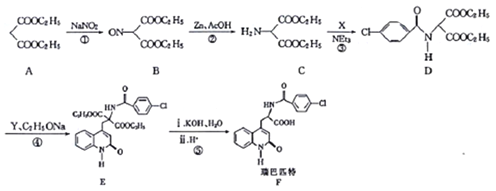
已知:Y的结构简式为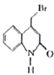
(1)A的化学名称为_______,A与足量NaOH溶液反应的化学方程式为___________。
(2)化合物C中官能团的名称为________。
(3)反应①的反应类型为______,反应②的反应类型为__________。
(4)C→D的转化过程中,生成的另一种产物为HCl,则X的结构简式为__________。
(5)芳香族化合物Z是X的同分异构体,能发生银镜反应且Z的核磁共振氢谱中有3组峰,则Z的结构简式为______(任写一种)。
(6)已知:①![]() HOCH2CH2CHO
HOCH2CH2CHO
②CH3CH2OH![]() CH3CH2Br。
CH3CH2Br。
请写出以A和![]() 为原料(无机试剂任选)制备
为原料(无机试剂任选)制备![]() 的合成路线流程图____。合成路线流程图示例如下:
的合成路线流程图____。合成路线流程图示例如下:
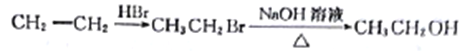
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法错误的是
A. 1 LpH=1 Ba(OH)2溶液中所含OH-的数目为0.2NA
B. 28g聚乙烯![]() 中含有的碳原子数为2NA
中含有的碳原子数为2NA
C. 1 mol CH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-的数目为NA
D. 1 mol Na与O2完全反应生成Na2O和Na2O2的混合物,转移的电子总数为NA
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①⑩种元素,填写下列空白:
族 周期 | IA | IIA | ⅢA | IVA | VA | VIA | ⅦA |
1 | ① | ||||||
2 | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)上述元素中,形成化合物种类最多的是_____________(填元素符号)。
(2)元素①、④和⑤形成的化合物的电子式是_______,该化合物中存在的化学键类型是_______。
(3)②、③、⑧三种元素原子半径由大到小的顺序是___________(用元素符号表示)。
(4)⑤、⑥、⑦三种元素最髙价氧化物对应水化物的碱性由强到弱的顺序是______________。(用对应物质的化学式表示)
(5)元素⑦和⑨最高价氧化物对应的水化物相互反应的离子方程式为___________________。
(6)能比较元素⑨和⑩非金属性强弱的实验事实是_________(填字母序号)。
a.⑨的氢化物的酸性比⑩的氢化物的酸性弱
b.⑩的单质R2与H2化合比⑨的单质Q与H2化合容易,且HR的稳定性比H2Q强
c.在⑨的氢化物H2Q的水溶液中通少量⑩的单质R2气体可置换出单质Q
查看答案和解析>>
科目: 来源: 题型:
【题目】冶炼金属一般有下列四种方法:①焦炭法;②水煤气(或H2、CO)法;③活泼金属置换法;④电解法。这四种方法在工业上均有应用。古代有:(Ⅰ)火烧孔雀石[主要成分是Cu2(OH)2CO3]炼铜;(Ⅱ)湿法炼铜。现代有:(Ⅲ)铝热法炼铬;(Ⅳ)从光卤石(主要成分是MgCl2)中炼镁。下列分析不正确的是
A. ①用于(Ⅰ) B. ②用于(Ⅱ) C. ③用于(Ⅲ) D. ④用于(Ⅳ)
查看答案和解析>>
科目: 来源: 题型:
【题目】镁—次氯酸盐燃料电池的工作原理如图所示,该电池反应为Mg+ClO-+H2O=Mg(OH)2+Cl-下列有关说法正确的是

A. 电池工作时,c溶液中的溶质是MgCl2
B. 电池工作时,正极a附近的pH将不断增大
C. 负极反应式:ClO--2e-+H2O=Cl-+2OH-
D. b电极发生还原反应,每转移0.1 mol电子,理论上生成0.1 mol Cl-
查看答案和解析>>
科目: 来源: 题型:
【题目】兴奋剂是体育比赛中禁用的药物,曾获得2013年欧洲冬季锦标赛4×400米接力银牌的俄罗斯运动员科特尔雅洛娃,近日被查出使用含有兴奋剂成分的药物。有一种兴奋剂的结构如图。关于它的说法中不正确的是( )
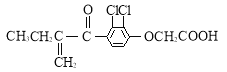
A.该有机物能发生酯化反应
B.该有机物属于芳香烃
C.既能发生还原反应,又能发生氧化反应
D.1 mol 该物质最多跟5mol氢气发生反应
查看答案和解析>>
科目: 来源: 题型:
【题目】利用钛白工业的副产品FeSO4(含Al2(SO4)3和少量重金属离子)可以生产电池级高纯超微细草酸亚铁。其工艺流程如下:

已知:①5Fe2++ MnO4-+8H+=5Fe3++Mn2++4H2O
5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O
(1)沉淀过程的反应温度为40℃,温度不宜过高的原因除了控制沉淀的粒径外,还有 。
(2)滤液经处理可得到副产品 。
(3)实验室测定高纯超微细草酸亚铁组成的步骤依次为:
步骤1:准确称量一定量草酸亚铁样品,加入25 mL 2 mol·L-1的H2SO4溶解。
步骤2:用0.2000 mol·L-1标准KMnO4溶液滴定,消耗其体积30.40 mL。
步骤3:向滴定后的溶液中加入2 g Zn粉和5 mL 2 mol·L-1的H2SO4溶液,将Fe3+还原为Fe2+。
步骤4:过滤,滤液用上述标准KMnO4溶液滴定,消耗溶液10.00 mL。
则样品中C2O42-的物质的量为 。(写出计算过程)
(4)将一定量高锰酸钾溶液与酸化的草酸亚铁溶液混合,测得反应 液中Mn2+的浓度随反应时间t的变化如图,其变化趋势的原因可能为 。

查看答案和解析>>
科目: 来源: 题型:
【题目】电解尿素[CO(NH2)2]是一种能耗很低的制氢方法,其工作原理如图所示,总反应为CO(NH2)2+2OH-![]() N2↑+3H2↑+CO32-。下列说法错误的是
N2↑+3H2↑+CO32-。下列说法错误的是

A. 阴极的材料可选择钢铁制品
B. 电解池工作时,阳极区域溶液的pH减小
C. 阳极的电极反应式为CO(NH2)2+8OH--6e-==N2↑+ CO32-+6H2O。
D. 若电路中通过3 mol 电子,则生成气体的总体积为33. 6L(标准状况)
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,向盛有60mL pH=4 HA溶液的绝热容器中加入pH=13的NaOH溶液,所得混合溶液的温度(T)与加入NaOH溶液体积(V)的关系如图所示。下列叙述不正确的是
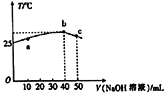
A. HA溶液的物质的量浓度为0.067mol·L-1
B. 25℃时,HA的电离平衡常数约为1.5×10-9
C. a→b的过程中,混合溶液中可能存在:c(A-)=c(Na+)
D. b点时:c(Na+)>c(A-)>c(OH-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com