
科目: 来源: 题型:
【题目】草酸钴用途广泛,可用于指示剂和催化剂制备。一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4·2H2O工艺流程如下:
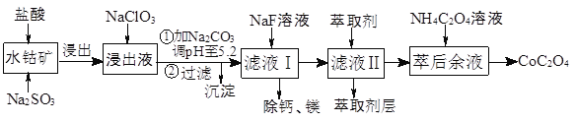
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3的目的是将_____________还原(填离子符号)以便固体溶解。该步反应的离子方程式为 (写一个)。
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,氯元素被还原为最低价。该反应的离子方程式为 。
(3)利用平衡移动原理分析:加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因是 。
(4)萃取剂对金属离子的萃取率与pH的关系如图所示。滤液Ⅱ中加入萃取剂的作用是 ;使用萃取剂适宜的pH=____(填序号)左右:
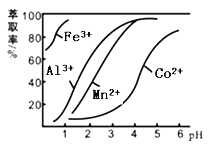
A.2.0 B.3.0 C. 4.0
(5)滤液Ⅰ“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)= 。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ca(H2PO2)2(次磷酸钙,一元中强酸H3PO2的钙盐)是一种白色结晶粉末,溶于水(常温时,溶解度16.7g/100g水),其水溶液呈现弱酸性。可用作医药、抗氧化剂以及制备次磷酸钠等。由白磷(P4)与石灰乳制备Ca(H2PO2)2的实验步骤如下:

步骤1.在三口烧瓶中加入白磷和石灰乳,先通入N2,然后在约98°C下充分搅拌1h,同时收集产生的PH3。
步骤2.将反应液静置、过滤。
步骤3.向滤液中通入适量CO2,再过滤。
步骤4.用次磷酸溶液调节步骤3滤液的pH,浓缩、冷却结晶、干燥得次磷酸钙。
(1)步骤1先通入N2的目的是 ;搅拌的目的是 。
(2)步骤1石灰乳与 P4(白磷)发生反应的化学方程式为 ;步骤2过滤所得滤渣成分为 。
(3)步骤3的目的是 。
(4)请补充完整由产品进一步制备NaH2PO2·H2O的实验方案:取产品次磷酸钙加入烧杯中,加适量的水溶解, ,干燥得到NaH2PO2·H2O。(已知:在常压下,加热蒸发次磷酸钠溶液会发生爆炸,100℃时NaH2PO2·H2O的溶解度为667g/100g水)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子在溶液中能大量共存的是
A. Fe3+、 NH 4 + 、SCN— 、 Cl—
B. Cl—、ClO—、OH—、Cu2+
C. AlO2—、H+、SO42—、Al3+
D. Ba2+ 、Na+ 、HCO3-、NO3—
查看答案和解析>>
科目: 来源: 题型:
【题目】两种气态烃A、B组成的混合气体完全燃烧后得到CO2和H2O(g)的物质的量随混合烃的总物质的量的变化如图所示,则下列说法正确的是( )
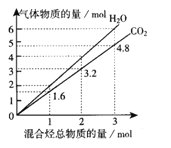
A. 混合烃中一定不含有乙烯 B. 混合烃中n(C)∶n(H)=2∶5
C. 若混合烃为CH4、C3H4,则体积比为3∶7 D. 若混合烃为CH4、C4H4,则体积比为4∶1
查看答案和解析>>
科目: 来源: 题型:
【题目】甲、乙两元素原子的L层电子数都是其他层电子总数的2倍,甲的原子半径大于乙的原子半径,下列说法正确是( )
A. 甲、乙处于同一周期 B. 它们中有一种元素位于第ⅥA族
C. 乙的最高价氧化物与甲的单质不反应 D. 简单甲离子的电子式为:Mg2+
查看答案和解析>>
科目: 来源: 题型:
【题目】某元素R最高价含氧酸的化学式为HaROb,则其最低价气态氢化物中R元素的化合价( )
A. 2b-a B. a-2b C. 8+a-2b D. 2b-a-8
查看答案和解析>>
科目: 来源: 题型:
【题目】氮氧化物排放是形成臭氧层空洞、酸雨、雾霾的重要成因之一。SCR法是工业上消除氮氧化物的常用方法,反应原理为:4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g) △H<0
4N2(g)+6H2O(g) △H<0
(1)氮氧化物破坏臭氧层原理为:①NO+O3![]() NO2+O2 ②NO2+O
NO2+O2 ②NO2+O![]() NO+O2
NO+O2
常温下反应①的平衡常数为K1,反应②的平衡常数为K2,则反应O3+O![]() 2O2的平衡常数K =________(用K1、K2表示)。
2O2的平衡常数K =________(用K1、K2表示)。
(2)SCR法除NO时,投料比一定时有利于提高NO平衡转化率的反应条件是________、________。该法可能发生副反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),减少副反应的主要措施是________、________。
4NO(g)+6H2O(g),减少副反应的主要措施是________、________。
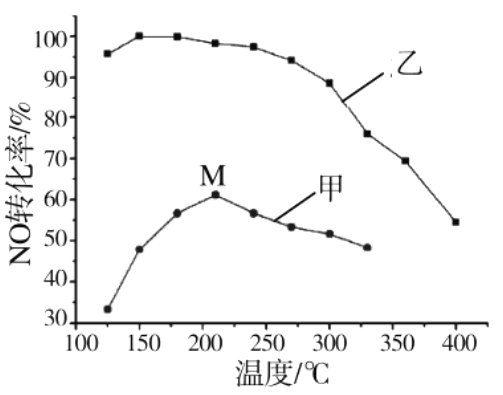
(3)其他条件相同,在甲、乙两种催化剂作用下,NO转化率与温度的关系如图。
①工业上选择催化剂乙的原因是________;
②在催化剂甲作用下,图中M点处(对应温度为210℃)NO的转化率_________(填“可能是”、“一定是”或“一定不是”)该温度下的平衡转化率。高于210℃时,NO转化率降低的原因可能是________。
(4)消除汽车尾气中的NO时,可用尿素[(NH2)2CO]还原NO,既安全又高效,且产物都是空气中含有的成分。与SCR法相比,等物质的量的尿素与氨气可消除的NO物质的量之比为________。(不考虑副反应)
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物F是一种具有强双光子性质的物质,可以通过以下方法合成:
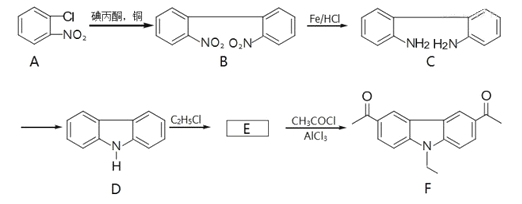
(1)在A、B、C、D、F中的含氧官能团名称为_______、________。
(2)B→C的反应类型为_________。
(3)E的分子是为C14H13N,写出E的结构简式_________。
(4)写出同时满足下列条件的F的一种同分异构体的结构简式_________。
①能发生银镜反应;②含有![]() 结构;
结构;
③分子中只有6种不同化学环境的氢。
(5)已知:![]()
请以苯和乙二醇为原料制备1,2-二苯基乙二醇![]() 写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_________。
写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】“纳米材料”是粒子直径为1~ 100nm的材料,纳米碳就是其中的一种,若将纳米碳均匀地分散到蒸馏水中,所形成的物质说法正确的是
①是浊液 ②是胶体 ③能产生丁达尔效应 ④能透过滤纸
⑤不能透过滤纸 ⑥静置后,会析出黑色沉淀
A. ① ⑤⑥ B. ②③④ C.②③⑤ D. ①③④⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com