
科目: 来源: 题型:
【题目】联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料。回答下列问题:
(1)联氨分子的电子式为 ,其中氮的化合价为 。
(2)实验室中可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为 。
(3)①2O2(g)+N2(g)==N2O4(l) △H1
②N2(g)+2H2(g)==N2H4(l) △H2
③O2(g)+2H2(g)==2H2O(g) △H3
④2N2H4(l)+N2O4(l)==3N2(g)+4H2O(g) △H4=-1048.9kJ-mol-1
上述反应热效应之间的关系式为△H4= ,联氨和N2O4可作为火箭推进剂的主要原因为 。
(4)联氨为二元弱碱,在水中的电离方式与氨相似。联氨第一步电离反应的平衡常数值为 (已知:N2H4+H+![]() N2H5+的K=8.7xl07; Kw=1.0xl0-14)。联氨与硫酸形成的酸式盐的化学式为 。
N2H5+的K=8.7xl07; Kw=1.0xl0-14)。联氨与硫酸形成的酸式盐的化学式为 。
(5)联氨是一种常用的还原剂。向装有少量AgBr的试管中加入联氨溶液,观察到的现象是 。联氨可用于处理高压锅炉水中的氧,防止锅炉被腐蚀。理论上1kg的联氨可除去水中溶解的O2 kg;与使用Na2S03处理水中溶解的O2相比,联氨的优点是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】C、N、O、Na、Al、Si、S、Cl是常见的八种元素
请回答下列问题:
(1)Si在元素周期表中的位置为__ ;CO2的电子式是_______。
(2)上述元素中原子半径最大的是(写元素符号)______;最高价氧化物对应的水化物酸性最强的是__________(写化学式)。
(3)下列事实能说明O元素的非金属性比S元素的非金属性强的是__。
a.O2与H2S溶液反应,溶液变浑浊
b.O和S两元素的简单氢化物受热分解,前者的分解温度高
c.在氧化还原反应中,1molO2比1molS得电子多
(4)金刚石具有优良的耐磨,耐腐蚀性,应用广泛。一定条件下,Na还原CCl4可制备金刚石。反应结束冷却至室温后,回收其中的CCl4的实验操作名称为_____,除去粗产品中少里钠的试剂为_______。
(5)常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图l),测得原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生。0~t1时,原电池的负极是Al片,此时,正极的电极反应式是_______,溶液中的H+向__极移动。t1时,原电池中电子流动方向发生改变,其原因是:___________。
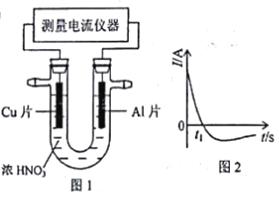
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物G(1,4-环己二醇)是重要的医药中间体和新材料单体,可通过以下流程制备。
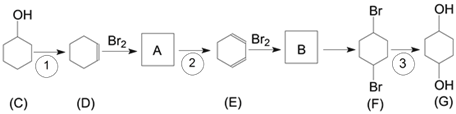
完成下列填空:
(1)写出C中含氧官能团名称_____________。
(2)判断反应类型:反应①_______________;反应③_________________。
(3)写出B的结构简式 _____________________。
(4)一定条件下D脱氢反应得一种产物,化学性质比较稳定,易取代、难加成。该产物属于_________(填有机物类别),说明该物质中碳碳键的特点____________________________。
(5)1,3-丁二烯是应用广泛的有机化工原料,它是合成D的原料之一,它还可以用来合成氯丁橡胶(![]() )。写出以1,3-丁二烯为原料制备氯丁橡胶的单体的合成路线。_________________
)。写出以1,3-丁二烯为原料制备氯丁橡胶的单体的合成路线。_________________
(合成路线常用的表示方式为:![]() )
)
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,用0.10 mol L-1的氨水滴定10.00 mL a mol L-1的盐酸,溶液的pH与氨水的体积(V)的关系如图所示。已知:N点溶液中存在:c(H+)=c(OH-)+c(NH3·H2O),下列说法正确的是

A. M点溶液中存在:c(H+)=c(OH-)+2c(NH3·H2O)+ c(NH4+)
B. N、Q两点溶液中NH3 H2O的电离常数:N<Q
C. P 点氨水过量,c(NH4+)> c(Cl-)
D. a=0.054
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.某化合物A的化学式为C5H11Cl,分析数据表明,分子中有两个“-CH3-”、两个“-CH2-”、一个“![]() ”和一个“-Cl-”,符合条件的同分异构体有__________种。结构简式分别为:
”和一个“-Cl-”,符合条件的同分异构体有__________种。结构简式分别为:![]() 、__________。
、__________。
Ⅱ.相对分子质量为128的芳香烃(分子中有两个六元环)的结构简式_____________。相对分子质量为128的烷烃的同分异构体可能有35种,其中只可以由一种对应单烯烃通过加氢反应得到的有__________种。
查看答案和解析>>
科目: 来源: 题型:
【题目】食醋是日常饮食中的一种调味剂,国家标准规定酿造食醋中醋酸含量不得低于3.5 g/100 mL。用中和滴定的方法可以测定食醋中醋酸的浓度,某白醋的醋酸浓度测定过程如下图所示:

![]()
完成下列填空:
(1)稀释白醋时需要的仪器有烧杯、_____________________________。
(2)应选用__________作为指示剂。达到滴定终点时,指示剂从____色变为_____色。
(3)某同学一共进行了三次实验。以下是他设计的实验数据记录表,表格中A是______________,B是_______________。
实验次数 | 稀释后白醋 体积(mL) | 标准NaOH溶液 | ||
A | B | 消耗体积(mL) | ||
1 | 20.00 | 22.05 | ||
2 | 20.00 | 21.34 | ||
3 | 20.00 | 21.30 | ||
数据处理:消耗标准NaOH溶液的体积=______________mL。
若测得稀释后白醋的浓度0.0594 mol/L,则该食醋______(选填“符合”、“不符合”)国家标准。
标准NaOH溶液通过以下步骤准备:①配制500 mL浓度约为0.1 mol/L的NaOH溶液;
②用KHC8H4O4标准溶液准确测定该NaOH溶液的浓度。
(4)称量所需的NaOH固体置于大烧杯中,加入500 mL蒸馏水,搅拌溶解,该配制步骤____________
(填“可行”或“不可行”)。
(5)NaOH标准溶液的浓度需通过测定而不能直接配制的原因是__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】A为某种聚甲基丙烯酸酯的单体,其转化关系如下:
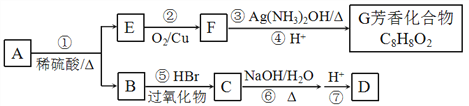
已知:Ⅰ.G的苯环上一氯代物只有两种;Ⅱ.RCH=CH2+HBr![]() RCH2CH2Br
RCH2CH2Br
请按要求回答下列问题:
(1)A的结构简式为____________________。
(2)下列说法不正确的是_______________。
a.②、③、⑤均为氧化反应
b.化合物B分子中所有碳原子共平面
c.化合物C的同系物2-甲基-2-溴丙酸能发生水解、消去、酯化反应
d.用新制碱性氢氧化铜悬浊液可鉴别E、F和G
(3)D可以发生缩聚反应,反应的化学方程式为__________________________________。
(4)写出同时满足下列条件的G的所有同分异构体的结构简式_____________________。
①红外光谱检测表明分子中含有醛基;
②1H-NMR谱显示分子中含有苯环,且苯环上有两种不同化学环境的氢原子。
以B为原料合成含六元环的酯类物质,请设计合成路线_____________________ (用流程图表示,无机试剂任选)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知碳化铝(Al4C3)与水反应生成氢氧化铝和甲烷。为了探究甲烷性质,某同学设计如下两组实验方案:甲方案探究甲烷与氧化剂反应(如图1所示);乙方案探究甲烷与氯气反应的条件(如图2所示)。
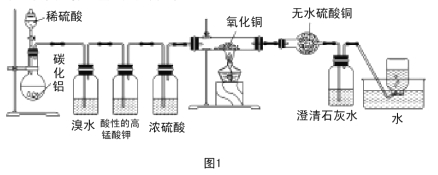
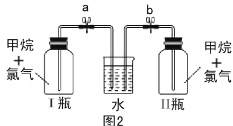
甲方案实验现象:溴水无颜色变化,无水硫酸铜变蓝色,澄清石灰水变浑浊。
乙方案实验操作过程:通过排饱和食盐水的方法收集两瓶甲烷与氯气(体积比为1∶4)的混合气体,I瓶放在光亮处,II瓶用预先准备好的黑色纸套套上,按图2安装好装置,并加紧弹簧夹a和b。
(1)碳化铝与稀硫酸反应的化学方程式为 。
(2)写出甲方案实验中硬质试管里可能发生的化学方程式 (实验测得消耗甲烷与氧化铜物质的量之比2∶7)。
(3)实验甲中浓硫酸的作用是 ,集气瓶中收集到的气体 (填“能”或“不能”)直接排入空气中?
(4)下列对甲方案实验中的有关现象与结论的叙述都正确的是( )
A.酸性高锰酸钾溶液不褪色,结论是通常条件下,甲烷不能与强氧化剂反应
B.硬质试管里黑色粉末变红色,说明氧化铜发生了氧化反应
C.硬质试管里黑色粉末变红色,推断氧化铜与甲烷反应只生成水和二氧化碳
D.甲烷不能与溴水反应,推知甲烷不能与卤素单质反应
(5)乙方案中烧杯里放入足量的水,打开弹簧夹a、b,一段时间后,观察到有水倒吸到I瓶中,但水并不能充满I瓶,请写出该实验现象所涉及的一个化学方程式 。除了上述现象外,该实验中还可能观察到的现象有 (填序号)。
A.I瓶中气体颜色变浅 B.I瓶中出现白雾
C.I瓶瓶内壁出现油状物质 D.II瓶中与I瓶现象相同
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是
A. 乙酸、水、乙醇和金属钠反应剧烈程度,从剧烈到逐渐平缓
B. 淀粉和纤维素的组成可用(C6H10O5)n 表示,它们互为同分异构体
C. 硝酸不慎滴到皮肤上,发现皮肤变黄
D. 苯的结构式虽然用![]() 表示,但苯的结构却不是单、双键交替组成的环状结构,可以从它的邻二氯代物结构只有一种得到证明
表示,但苯的结构却不是单、双键交替组成的环状结构,可以从它的邻二氯代物结构只有一种得到证明
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com