
科目: 来源: 题型:
【题目】主族元素在周期表中的位置取决于该元素原子的
A. 相对原子质量和核外电子数 B. 相对原子质量和最外层电子数
C. 电了层数和最外层电子数 D. 电子层数和次外层电子数
查看答案和解析>>
科目: 来源: 题型:
【题目】恒容密闭容器中进行的可逆反应2NO2![]() 2NO+O2,达到平衡状态的是
2NO+O2,达到平衡状态的是
①单位时间内生成a mo1 O2的同时生成2a mol NO2
②单位时间内生成a mol O2的同时生成2a molNO
③混合气体的颜色不再改变
④混合气体的密度不再改变的状态
⑤混合气体的平均相对分子质量不再改变的状态
A.①③④ B.②④⑤ C.①③⑤ D.①②③④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】我国是干电池的生产和消费大国。某科研团队设计了以下流程对碱性锌锰干电池的废旧资源进行回收利用:

已知:①Ksp(MnS)=2.5×10-13,Ksp(ZnS)=1.6×10-24
②Mn(OH)2开始沉淀时pH为8.3,完全沉淀的pH为9.8
⑴碱性锌锰干电池是以锌粉为负极,二氧化锰为正极,氢氧化钾溶液为电解质。电池总反应为2MnO2+ Zn+2KOH= 2MnOOH+K2ZnO2,请写出电池的正极反应式_____________;
⑵为了提高碳包的浸出效率,可以采取的措施有________________________;(写一条即可)
⑶向滤液1中加入MnS的目的是__________________________________________;
⑷已知MnSO4的溶解度曲线如图所示,从滤液2中析出MnSO4·H2O晶体的操作是蒸发结晶、____________________、洗涤、低温干燥;
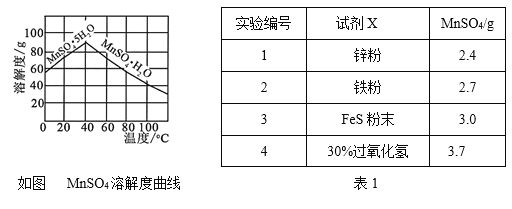
⑸为了选择试剂X,在相同条件下,分别用3 g碳包进行制备MnSO4的实验,得到数据如表1,请写出最佳试剂X与碳包中的主要成分发生反应的化学方程式_____________。
⑹工业上经常采用向滤液2中加入NaHCO3溶液来制备MnCO3,不选择Na2CO3溶液的原因是___________________________________;
⑺该科研小组利用EDTA(乙二胺四乙酸二钠,阴离子简写为Y2-)进行络合滴定测定Mn2+在电池中的百分含量,化学方程式可以表示为Mn2++Y2-=MnY。实验过程如下:
准确称量一节电池的质量平均为24.00g,完全反应后,得到200.00mL滤液2,量取10.00mL滤液2稀释至100.00mL,取20.00mL溶液用0.0500molL-1EDTA标准溶液滴定,平均消耗标准溶液22.00mL,则该方案测得Mn元素的百分含量为________。(保留3位有效数字)
查看答案和解析>>
科目: 来源: 题型:
【题目】慢心律是一种治疗心律失常的药物,它的合成路线如下:
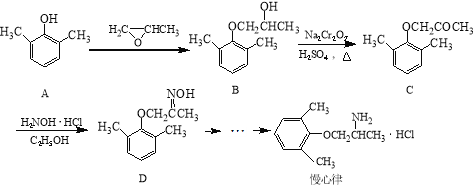
(1)由B→C的反应类型为 。
(2)C分子中有2个含氧官能团,分别为 和 (填官能团名称)。
(3)写出A与浓溴水反应的化学方程式 。
(4)由A制备B的过程中有少量副产物E,它与B互为同分异构体,E的结构简式为 。
(5)写出同时满足下列条件的D的一种同分异构体的结构简式 。
①属于α-氨基酸;
②是苯的衍生物,且苯环上的一氯代物只有两种;
③分子中含有两个手性碳原子。
(6)已知乙烯在催化剂作用下与氧气反应可以生成环氧乙烷(![]() )。写出以邻甲基苯酚(
)。写出以邻甲基苯酚( 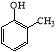 )和乙醇为原料制备
)和乙醇为原料制备 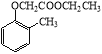 的合成路线流程图(无机试剂任用)。
的合成路线流程图(无机试剂任用)。
合成路线流程图示例如下:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,将某一元酸HX和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
试验编号 | HX的物质的量浓度(mol/L) | NaOH的物质的量浓度(mol/L) | 混合溶液的PH |
甲 | 0.2 | 0.2 | PH=a |
乙 | c1 | 0.2 | PH=7 |
丙 | 0.2 | 0.2 | PH>7 |
丁 | c2 | c3 | PH=10 |
请回答:
(1)不考虑其他组的实验结果,单从甲组情况分析,若a________7(填“>”“<”或“=”),则HX为强酸;若a________7(填“>”“<”或“=”),则HX为弱酸.
(2)在乙组混合溶液中离子浓度c(X-)与c(Na+)的大小关系是________.
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)丙溶液中离子浓度由大到小的顺序是_____________________________.
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=________mol/L.
查看答案和解析>>
科目: 来源: 题型:
【题目】现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。在图中圆括号表示加入适当的试剂,编号表示适当的分离方法。

(1)写出各有机物的名称:
A ________________ ;B _____________________;C ____________________ ;
D ________________ ;E ____________________。
(2)写出加入的试剂
(a)是_________________________;(b)是___________________________。
(3)写出有关的操作分离方法
①是_________________,②是__________________,③是__________________。
(4)写出C→D 反应的化学方程式 _____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下面是甲、乙、丙三位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关实验任务。
【实验目的】制取乙酸乙酯
【实验原理】甲、乙、丙三位同学均采取乙醇、乙酸与浓硫酸混合共热的方法制取乙酸乙酯。
【装置设计】甲、乙、丙三位同学分别设计了下列三套实验装置:
请从甲、乙两位同学设计的装置中选择一种作为实验室制取乙酸乙酯的装置,较合理的是________(选填“甲”或“乙”)。丙同学将甲装置进行了改进,将其中的玻璃管改成了球形干燥管,除起冷凝作用外,另一重要作用是_______。
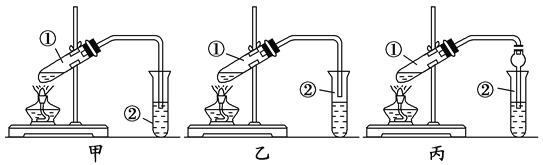
【实验步骤】
(1)用酒精灯对试管①加热;(2)将试管①固定在铁架台上(3)按所选择的装置组装仪器,在试管①中先加入3 mL乙醇,并在摇动下缓缓加入2 mL浓硫酸充分摇匀,冷却后再加入2 mL冰醋酸;(4)在试管②中加入适量的饱和Na2CO3溶液;(5)当观察到试管②中有明显现象时停止实验。
【问题讨论】
a.用序号写出该实验的步骤____________;
b.装好实验装置,加入药品前还应检查____________;
c.写出试管①发生反应的化学方程式(注明反应条件) _____________________;
d.试管②中饱和Na2CO3溶液的作用是_____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】砷为VA族元素,金属冶炼过程产生的含砷有毒废弃物需处理与检测。
I.冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:

已知:①As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq)![]() 2AsS33-(aq);
2AsS33-(aq);
②亚砷酸盐的溶解性大于相应砷酸盐。
(1)亚砷酸中砷元素的化合价为________;砷酸的第一步电离方程式为_____________。
(2)“一级沉砷”中FeSO4的作用是___________;“二级沉砷”中H2O2与含砷物质反应的化学方程式为_____________。
(3)沉淀X为___________(填化学式)。
Ⅱ.冶炼废渣中的砷元素主要以As2S3的形式存在,可用古氏试砷法半定量检测(As的 最低检出限为3.0×10-6g)。
步骤1:取10g废渣样品,粉碎后与锌粉混合,加入H2SO4共热,生成AsH3气体。
步骤2:将AsH3气体通入AgNO3溶液中,生成银镜和As2O3。
步骤3:取1g废渣样品,重复上述实验,未见银镜生成。
(4)AsH3的电子式为_______________。
(5)步骤2的离子方程式为_________________。
(6)固体废弃物的排放标准中,砷元素不得高于4.0×10-5g·kg-1,请通过计算说明该排放的废渣中砷元素的含量_______(填“符合”、“不符合”)排放标准,原因是__________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com