
科目: 来源: 题型:
【题目】利用下图所示的有机物X可生产S-诱抗素Y。下列说法正确的是
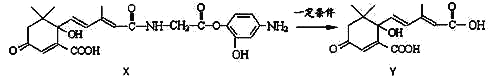
A. 1 mol Y最多能和6 molH2发生加成反应
B. X可以发生氧化、取代、加聚、酯化等反应
C. Y可以与FeCl3溶液发生显色反应,又可使酸性高锰酸钾溶液退色
D. X结构中有2个手性碳原子
查看答案和解析>>
科目: 来源: 题型:
【题目】HIO4主要以H5IO6形式存在,H5IO6是白色晶体,易溶于水,具有很强的氧化性,在强酸溶液中能氧化Mn2+。
(1)请完成并配平下列离子反应。
__________Mn2++________H5IO6![]() __________
__________![]() +________
+________![]() +________H++________
+________H++________
(2)根据以上离子方程式判断H5IO6是________电离物质(填“易”或“难”)。
(3)上述反应,被氧化的元素是________(填元素符号),当1 mol Mn2+参加反应时,转移电子的物质的量为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氧化与还原在同一元素中进行的是
A.Cl2+2NaOH![]() NaCl+NaClO+H2O B.Fe+CuSO4
NaCl+NaClO+H2O B.Fe+CuSO4![]() FeSO4+Cu
FeSO4+Cu
C.2H2O![]() 2H2↑+O2↑ D.2KClO3
2H2↑+O2↑ D.2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】生产生活中处处有化学,下列表述错误的是
A. 低碳生活的核心就是节约能源,减少温室气体的排放
B. 硅酸钠的水溶液俗称水玻璃,是制备硅胶和木材防火剂的原料
C. 二氧化硫可用于漂白食品
D. 用醋酸可去除热水瓶内的水垢
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究小组探究在加热条件下FeSO4分解的气体产物及相关性质。已知:SO2的沸点为-10℃、SO3的沸点为44.8℃。
Ⅰ.用如图所示装置设计实验,验证分解FeSO4生成的气态产物。
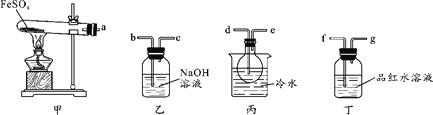
(1)实验前必须进行的操作是_______________________。
(2)按气流方向连接各仪器,用字母表示接口的连接顺序:a→_________________。
(3)若观察到装置丙中有无色液体产生,装置丁中溶液变成无色,则 FeSO4分解的化学方程式为____________________。
Ⅱ.为探究SO2使品红溶液褪色的原理,进行如下实验:
实验1:将稀盐酸和NaOH溶液分别滴入品红水溶液中。观察到前者溶液颜色变浅,但未能完全褪色,后者溶液颜色几乎不变。
实验2:在滴有稀盐酸和NaOH溶液的两份品红水溶液中分别通入SO2。观察到前者溶液逐渐褪色,后者溶液很快褪色。
实验3:在两份品红水溶液中分别加入一小粒Na2SO3固体和NaHSO3固体,前者溶液很快褪色,后者溶液褪色很慢。
(1)由实验1可推测品红水溶液呈________性。
(2)由实验2、3可推知,使品红水溶液褪色的主要微粒是_________(填化学式)。
(3)若将SO2通入品红的无水乙醇溶液,试预测可能出现的现象________________。
(4)加热溶有Na2SO3的品红水溶液,发现不能恢复红色,试解释原因____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂。
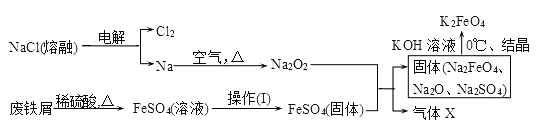
(1)工业上的湿法制备方法是用KClO与Fe(OH)3在KOH存在下制得K2FeO4,该反应氧化剂与还原剂物质的量之比为________________。
(2)实验室用食盐、废铁屑、硫酸、KOH等为原料,通过以下过程制备K2FeO4:
①操作(Ⅰ)的方法为_________________,隔绝空气减压干燥。
②检验产生X气体的方法是________________。
③最终在溶液中得到K2FeO4晶体利用的原理是____________________。
(3)测定某K2FeO4样品的质量分数,实验步骤如下:
步骤1:准确称量1.0g样品,配制100mL溶液,
步骤2:准确量取25.00mL K2FeO4溶液加入到锥形瓶中
步骤3:在强碱性溶液中,用过量CrO2-与FeO42-反应生成Fe(OH)3和CrO42-
步骤4:加稀硫酸,使CrO42-转化为Cr2O72-,CrO2-转化为Cr3+,Fe(OH)3转化为Fe3+
步骤5:加入二苯胺磺酸钠作指示剂,用0.1000mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显紫红色),记下消耗(NH4)2Fe(SO4)2溶液的体积,做3次平行实验,平均消耗(NH4)2Fe(SO4)2溶液的体积30.00 mL。
已知:滴定时发生的反应为:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O。
①步骤2中准确量取25.00mL K2FeO4溶液加入到锥形瓶中所用的仪器是______________。
②写出步骤3中发生反应的离子方程式__________________________。
③步骤5中能否不加指示剂_________,原因是________________。
④根据上述实验数据,测定该样品中K2FeO4的质量分数为__________。
(4)配制0.1mol·L-1的K2FeO4,调节溶液pH,含铁离子在水溶液中的存在形态如图所示。下列说法正确的是__________ (填字母)。
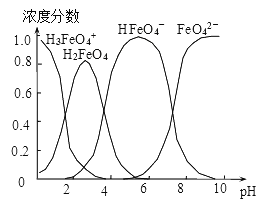
A.pH=2时,c(H3FeO4+)+c(H2FeO4)+c(HFeO4-)=0.1mol·L-1
B.向pH=10的这种溶液中加硫酸铵,则HFeO4-的分布分数逐渐增大
C.向pH=1的溶液中加HI溶液,发生反应的离子方程式为:H2FeO4+H+=H3FeO4+
D.将K2FeO4晶体溶于水,水溶液呈弱碱性
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质结构图中,●代表原子序数从1到10的元素的原子实(原子实是原子除去最外层电子后剩余的部分),小黑点代表除形成共价键外的其他最外层电子,短线代表共价键,如F2:![]() 。
。
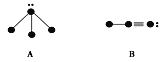

⑴试写出四种图示所代表的化学式:
A___________,B___________,C___________,D___________。
⑵将上述四种物质的液体呈细流流下,用带静电的玻璃棒靠近细流,细流发生偏转的是_____________(填“A”“B”“C”“D”)。
⑶B分子中有__________个δ键,___________个π键。
⑷C分子中,中心原子杂化类型____________其分子空间构型是_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】碳酸亚乙烯酯结构如右图所示。下列有关该物质的说法正确的是( )

A. 分子中含6个σ键
B. 分子式为C3H2O3
C. 分子中只有极性键
D. 8.6 g该物质完全燃烧得到6.72 L CO2
查看答案和解析>>
科目: 来源: 题型:
【题目】CH4、H2、C都是优质的能源物质,它们燃烧的热化学方程式为:
①CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ/mol
②2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ/mol
③C(s)+O2(g)===CO2(g) ΔH=-393.5kJ/mol
⑴深海中存在一种甲烷细菌,它们依靠酶使甲烷与O2作用产生的能量存活,甲烷细菌使1mol甲烷生成CO2气体与液态水,放出的能量_________(填“>”“<”或“=”)890.3 kJ。
⑵甲烷与CO2可用于合成合成气(主要成分是一氧化碳和氢气):CH4+CO2===2CO+2H2,1gCH4完全反应可释放15.46 kJ的热量,则:
①图中能表示该反应过程中能量变化的是_______(填字母)。

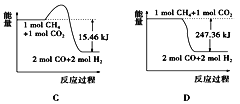
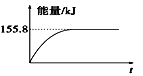
②若将物质的量均为1 mol的CH4与CO2充入某恒容密闭容器中,体系放出的热量随着时间的变化如图所示,则CH4的转化率约为____________。
⑶C(s)与H2(g)不反应,所以C(s)+2H2(g)===CH4(g)的反应热无法直接测量,但通过上述反应可求出C(s)+2H2(g)===CH4(g)的反应热ΔH=__________。
⑷下图是甲烷燃料电池原理示意图,请回答下列问题:
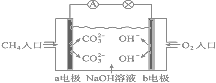
①电池的负极是______(填“a”或“b”)电极,正极上的电极反应是_________。
②电池工作一段时间后电解质溶液的pH______(填“增大”“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com