
科目: 来源: 题型:
【题目】我国是干电池的生产和消费大国。某科研团队设计了以下流程对碱性锌锰干电池的废旧资源进行回收利用:

已知:①Ksp(MnS)=2.5×10-13,Ksp(ZnS)=1.6×10-24
②Mn(OH)2开始沉淀时pH为8.3,完全沉淀的pH为9.8
⑴碱性锌锰干电池是以锌粉为负极,二氧化锰为正极,氢氧化钾溶液为电解质。电池总反应为2MnO2+ Zn+2KOH= 2MnOOH+K2ZnO2,请写出电池的正极反应式_____________;
⑵为了提高碳包的浸出效率,可以采取的措施有________________________;(写一条即可)
⑶向滤液1中加入MnS的目的是__________________________________________;
⑷已知MnSO4的溶解度曲线如图所示,从滤液2中析出MnSO4·H2O晶体的操作是蒸发结晶、____________________、洗涤、低温干燥;
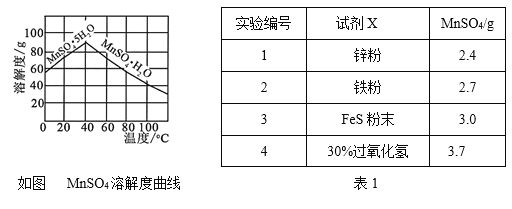
⑸为了选择试剂X,在相同条件下,分别用3 g碳包进行制备MnSO4的实验,得到数据如表1,请写出最佳试剂X与碳包中的主要成分发生反应的化学方程式_____________。
⑹工业上经常采用向滤液2中加入NaHCO3溶液来制备MnCO3,不选择Na2CO3溶液的原因是___________________________________;
⑺该科研小组利用EDTA(乙二胺四乙酸二钠,阴离子简写为Y2-)进行络合滴定测定Mn2+在电池中的百分含量,化学方程式可以表示为Mn2++Y2-=MnY。实验过程如下:
准确称量一节电池的质量平均为24.00g,完全反应后,得到200.00mL滤液2,量取10.00mL滤液2稀释至100.00mL,取20.00mL溶液用0.0500molL-1EDTA标准溶液滴定,平均消耗标准溶液22.00mL,则该方案测得Mn元素的百分含量为________。(保留3位有效数字)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有机物的命名正确的是( )
A.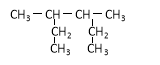 3-甲基-2-乙基戊烷
3-甲基-2-乙基戊烷
B.(CH3)3CCH2CH(C2H5)CH3 2,2-二甲基-4-乙基戊烷
C. 邻甲基苯酚
邻甲基苯酚
D.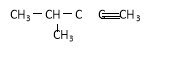 2-甲基-3-戊炔
2-甲基-3-戊炔
查看答案和解析>>
科目: 来源: 题型:
【题目】NO和CO都是汽车尾气中的有害物质,它们缓慢起反应生成氮气和二氧化碳,即:2NO+2CO2CO2+N2,对此反应下列叙述正确的是( )
A. 使用催化剂不改变反应速率B. 降低压强,反应速率增大
C. 升高温度能加快反应速率D. 增加N2的浓度,反应速率减慢
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. 二氧化硅是酸性氧化物,它可以跟碱反应,不能和任何酸反应
B. 光导纤维的主要成分是晶体硅
C. 硅石、石英、水晶、玛瑙中都含有二氧化硅
D. 明矾净水是因为其具有杀菌消毒的性质
查看答案和解析>>
科目: 来源: 题型:
【题目】在日常生活中,我们经常看到铁制品生锈、铝制品表面出现白斑等众多的金属腐蚀现象。可以通过下列装置所示实验进行探究。下列说法正确的是
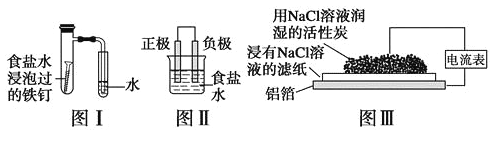
A.按图Ⅰ装置实验,为了更快更清晰地观察到液柱上升,可采用下列方法:用酒精灯加热具支试管
B.图Ⅱ是图Ⅰ所示装置的原理示意图,图Ⅱ的正极材料是铁
C.铝制品表面出现白斑可以通过图Ⅲ装置进行探究,Cl-由活性炭区向铝箔表面区迁移,并发生电极反应:2Cl--2e-=Cl2↑
D.图Ⅲ装置的总反应为4Al+3O2+6H2O=4Al(OH)3,生成的Al(OH)3进一步脱水形成白斑
查看答案和解析>>
科目: 来源: 题型:
【题目】已知As2O3与Zn可以发生如下反应:As2O3+6Zn+6H2SO4![]() 2AsH3↑+6ZnSO4+3H2O。
2AsH3↑+6ZnSO4+3H2O。
(1)请用双线桥法标出电子转移的方向和数目____________________________________。
(2)As2O3在上述反应中显示出来的性质是____________(填序号)。
A.氧化性 B.还原性 C.酸性 D.碱性
(3)该反应的氧化产物是__________,还原产物是________。
(4)若生成0.2 mol AsH3,则转移的电子数为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】聚合反应是制备新型材料的重要途径。由天然橡胶的单体A制备的化合物F、K发生加聚反应可得到新型高分子材料。
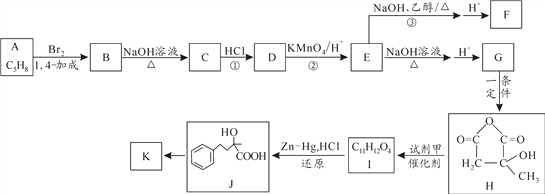
已知:①E的结构简式为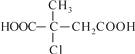 ,红外光谱法测得F、K分子均含有甲基。
,红外光谱法测得F、K分子均含有甲基。
②![]()
(1)A按系统命名法的名称为_____________________。
(2)反应①的反应类型为________________,设计步骤①③目的是______________。
(3)有机物甲的结构简式为_______________。
(4)写出F与K按物质的量1:1共聚形成高分子化合物的化学方程式为______________________________。
(5)有机物乙是J的同系物,且比J少一个碳原子,乙有多种同分异构体,其中能满足下列条件的同分异构体有_________种。
a.含有酚羟基
b.能发生水解反应且能发生银镜反应
c.苯环上的一氯代物只有一种
d.核磁共振氢谱有5组峰
(6)参照上述合成路线,设计一条由乙二醇和苯为原料(无机试剂任选)制备苯乙酸 (![]() )的合成路线_________。
)的合成路线_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ、前20号元素A、B、C、D,其中A元素所处的周期数、主族序数、原子序数均相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层少2个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C。
(1)C在周期表中的位置__________________________;
(2)B 元素的原子结构示意图____________________________;
(3)化合物D2C的电子式______________________________;
(4)B最简单气态氢化物与最简单的有机物的稳定性强弱关系(用相应的化学式表示):____ > ____;
(5)C、D离子的半径大小关系为C______D (填:>、=、<);
(6)B的氢化物与B的最高价氧化物对应水化物反应的生成物中含有的的化学键有__________填选项)。
A、只含离子键 B、既有离子键又有共价健
C、只含有共价键 D、既有极性共价键又有非极性共价键
Ⅱ、利用下图装置来验证同主族元素非金属性的变化规律:
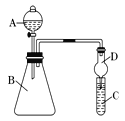
(1)要证明非金属性:Cl>I,在A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾溶液,观察到C中溶液现象是:___________,即可证明。干燥管D的作用是___________________。从环境保护的角度考虑,此装置尚缺少尾气处理装置,可用_________________溶液吸收尾气。
(2)要证明非金属性:C>Si,在A中加盐酸,B中加CaCO3,C中加Na2SiO3溶液,将观察到C中______________的现象。但老师认为,该现象不足以证明酸性强弱关系为碳酸>硅酸,因此应在B、D之间增加一个盛有足量__________的洗气装置(选填下列字母)
A.浓盐酸 B.浓NaOH溶液 C.饱和Na2CO3溶液 D.饱和NaHCO3溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】⑴反应N2(g)+3H2(g)2NH3(g)在恒温恒容条件下进行,下列情况中,处于平衡状态的是________;反应正向进行的是________;反应逆向进行的是_________.(填序号)
A.单位时间内消耗2mol N2,同时生成4mol NH3
B.单位时间内消耗3mol H2,同时生成2mol NH3
C.单位时间内生成2mol N2,同时生成6mol N—H键
D.混合气的密度不再随时间而改变
E.容器中气体的压强不再随时间而改变
F.单位时间内生成2mol NH3,同时又生成2mol H—H键
⑵恒温下,将amol N2与bmol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2(g)+3H2(g)2NH3(g)
反应进行到某时刻t时,nt(N2)=13mol,nt(NH3)=6mol,a =_________;
反应达平衡时,混合气体的体积为716.8L(标准状况下),其中NH3的体积分数为25%。平衡时NH3的物质的量为___________;
原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n(始):n(平)=______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com