
科目: 来源: 题型:
【题目】某蓄电池反应为NiO2+Fe+2H2O![]() Fe(OH)2+Ni(OH)2。
Fe(OH)2+Ni(OH)2。
(1)该蓄电池充电时,发生还原反应的物质是 (填下列字母),放电时生成Fe(OH)2的质量18 g,则外电路中转移的电子数是 。
A.NiO2 B.Fe C.Fe(OH)2 D.Ni(OH)2
(2)为防止远洋轮船的钢铁船体在海水中发生电化学腐蚀,通常把船体与浸在海水里的Zn块相连,或与该蓄电池这样的直流电源的 极(填“正”或“负”)相连。
(3)以该蓄电池做电源,用右图所示装置,在实验室模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊,原因是(用相关的电极反应式和离子方程式表示)。 。

(4)精炼铜时,粗铜应与直流电源的 极(填“正”或“负”)相连,精炼过程中,电解质溶液中c(Fe2+)、c(Zn2+)会逐渐增大而影响进一步电解,甲同学设计如下除杂方案:
![]()
已知:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
开始沉淀时的pH | 2.3 | 7.5 | 5.6 | 6.2 |
完全沉淀时的pH | 3.9 | 9.7 | 6.4 | 8.0 |
则加入H2O2的目的是 ,乙同学认为应将方案中的pH调节到8,你认为此观点 (填“正确”或“不正确”),理由是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】过氧化氢溶液可作为采矿业废液消毒剂,如消除采矿废液中剧毒的氰化钾,反应方程式为KCN+H2O2+H2O![]() A+NH3↑(已配平),请回答:(提示:
A+NH3↑(已配平),请回答:(提示:![]() 、
、![]() )
)
(1)生成物A的化学式是_____________________________。
(2)该反应是否是氧化还原反应?________(填写“是”或“否”),其理由是_____________________。若是,则被还原的元素是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,用 0.1000 mol/L NaOH溶液滴定 20.00mL0.1000 mol/L CH3COOH溶液所得滴定曲线如图。下列说法正确的是
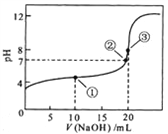
A. 点①所示溶液中:c(CH3COO-)+ c(OH-)=c(CH3COOH)+ c(H+)
B. 点②所示溶液中:c(Na+)=c(CH3COOH)+ c(CH3COO-)
C. 点③所示溶液中:c(Na+) >c(OH-) >c(CH3COO-) > c(H+)
D. 滴定过程中可能出现:c(CH3COOH) >c(CH3COO-) > c(H+)>c(Na+) >c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】在下列有关晶体的叙述中,错误的是( )
A. 离子晶体中一定含有离子键B. 原子晶体中,只存在共价键
C. 构成分子晶体的物质中不存在共价键D. 稀有气体的原子易形成分子晶体
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,将两烧杯中电极用导线相连,四个电极分别为Mg、Al、Pt、C。当闭合开关S后,以下表述正确的是( )
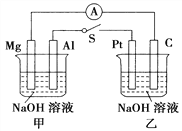
A. 电流表指针不发生偏转
B. Al、Pt两极有H2产生
C. 甲池pH减小,乙池pH不变
D. Mg、C两极生成的气体在一定条件下可以恰好完全反应
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法与盐类水解无关的是
A. 粗盐在空气中易潮解 B. NH4Cl用于金属焊接中除锈
C. 用热纯碱溶液去油污 D. 蒸干并灼烧FeCl3溶液得到Fe2O3
查看答案和解析>>
科目: 来源: 题型:
【题目】运用元素周期律分析下面的推断,其中错误的是
A. 氢氧化铯(CsOH)为强碱
B. 砹单质(At2)为有色固体,HAt不稳定
C. 碳酸锶(SrCO3)是难溶于水的固体
D. 硒化氢(H2Se)比硫化氢稳定
查看答案和解析>>
科目: 来源: 题型:
【题目】碘盐中添加的碘酸钾在工业上可用电解KI溶液制取,电极材料是石墨和不锈钢,化学方程式是:KI+3H2O![]() KIO3+3H2↑,有关说法不正确的是
KIO3+3H2↑,有关说法不正确的是
A.石墨作阳极,不锈钢作阴极
B.I-在阳极放电,H+在阴极放电
C.电解过程中电解质溶液的pH变小
D.电解转移3 mol e-时,理论上可制得KIO3 107 g
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇(CH3OH)是重要的溶剂和替代燃料,工业常以CO和H2的混合气体为原料一定条件下制备甲醇。
(1)甲醇与乙醇互为_______________;完全燃烧时,甲醇与同物质的量的汽油(设平均组成为C8H18)消耗O2量之比为________。
(2)工业上常用“水煤气法”获得CO和H2,其反应原理如下:
C(s) + H2O(g) ![]() CO(g) + H2(g) CO(g) + H2O(g)
CO(g) + H2(g) CO(g) + H2O(g) ![]() CO2(g) + H2(g)
CO2(g) + H2(g)
某水煤气样品中含0.2LCO、0.5LCO2,则该样品中含H2__________L。
(3)工业上还可以通过下列途径获得H2,其中节能效果最好的是________。
A. 高温分解水制取H2:2H2O![]() 2H2↑+ O2↑
2H2↑+ O2↑
B. 电解水制取H2:2H2O![]() 2H2↑+ O2↑
2H2↑+ O2↑
C. 甲烷与水反应制取H2:CH4 + H2O![]() 3H2 + CO
3H2 + CO
D. 在光催化剂作用下,利用太阳能分解水制取H2:2H2O![]() 2H2↑+ O2↑
2H2↑+ O2↑
(4)在2L的密闭容器中充入1molCO和2molH2,一定条件下发生反应:CO(g)+2H2(g) ![]() CH3OH(g),测得CO和CH3OH(g)浓度变化如下图所示。
CH3OH(g),测得CO和CH3OH(g)浓度变化如下图所示。
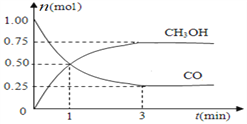
① 从反应开始到平衡,氢气的平均反应速率v(H2)=_______________mol·(L·min)—1。
反应前后容器的压强比为__________ ,平衡时氢气的体积分数为________________。
② 能够判断该反应达到平衡的是_______(填选项)。
A.CO、H2和CH3OH三种物质的浓度相等
B.密闭容器中混合气体的密度不再改变
C.CH3OH分解的速率和CH3OH生成的速率相等
D.相同时间内消耗1 mol CO,同时消耗1 mol CH3OH
(5)为使合成甲醇原料的原子利用率达100%,实际生产中制备水煤气时还使用CH4,则生产投料时,n(C)∶n(H2O)∶n(CH4)=__________。
(6)据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量是现用镍氢电池和锂电池的10倍,可连续使用一个月才充电一次。假定放电过程中,甲醇完全氧化产生二氧化碳被充分吸收生成CO![]() 。写出该电池负极电极反应式_________。正极电极反应式_________________。电池中放电过程中溶液pH将_____(填“下降”、“上升”或“不变”)。
。写出该电池负极电极反应式_________。正极电极反应式_________________。电池中放电过程中溶液pH将_____(填“下降”、“上升”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com