
科目: 来源: 题型:
【题目】下列操作中最终可以得到Al(OH)3的是( )
A. Al2O3和水混合加热
B. 过量的稀HCl加入到Na[Al(OH)4]溶液中
C. 过量的NaOH溶液加入到AlCl3溶液中
D. 过量的氨气通入到AlCl3溶液中
查看答案和解析>>
科目: 来源: 题型:
【题目】不能用勒夏特列原理解释的是
A. 使用铁触媒,加快合成氨反应速率 B. 实验室用排饱和食盐水法收集氯气
C. 打开汽水瓶盖,即有大量氕泡逸出 D. 温度升高,纯水中的H+浓度增大
查看答案和解析>>
科目: 来源: 题型:
【题目】金属加工后的废切削液中含有2%~5%的NaNO2,它是一种环境污染物。人们用NH4Cl溶液来处理此废切削液,使亚硝酸钠转化为无毒物质。该反应分两步进行:
第一步:NaNO2+NH4Cl![]() NaCl+NH4NO2
NaCl+NH4NO2
第二步:NH4NO2![]() N2↑+2H2O
N2↑+2H2O
下列对第二步反应的叙述中正确的是
①NH4NO2仅是氧化剂
②NH4NO2仅是还原剂
③NH4NO2发生了分解反应
④只有氮元素的化合价发生了变化
⑤NH4NO2既是氧化剂又是还原剂
A.①③ B.①④
C.②③④ D.③④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定。
为测定产品纯度,进行了如下实验:准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0 mol·L-1碘的标准溶液滴定。
反应原理为:2S2O32+I2==S4O62+2I-
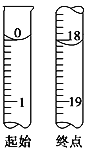
请填写下列空白:
①用标准碘溶液滴定待测溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视____________________。滴定至终点时,溶液颜色________,且半分钟内保持不变,即停止滴定。
②测定起始和终点的液面位置如图,则消耗碘的标准溶液体积为________mL。产品的纯度为(设Na2S2O3·5H2O相对分子质量为M)______________________________________
③下列操作中可能使所测产品的纯度数值偏低的是________(填字母)。
A.酸式滴定管未用标准碘溶液润洗就直接注入标准碘溶液
B.滴定前,锥形瓶用蒸馏水洗涤后,未用待测的溶液润洗就做滴定
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取标准碘溶液体积时,开始仰视读数,滴定结束时俯视读数
E.滴定过程中,锥形瓶的振荡过于激烈,使少量溶液溅出
(2)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化成H2SO3,然后用一定浓度的I2溶液进行滴定,所用指示剂为________,滴定反应的离子方程式为________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】S2Cl2是一种重要的化工产品。常温时是一种有毒并有恶臭的金黄色液体,熔点-76℃,沸点138℃,易与水反应,进一步氯化可得SCl2。SCl2是樱桃红色液体,易挥发,熔点-122℃,沸点59℃。SCl2 与S2Cl2相似,有毒并有恶臭,且更不稳定。S2Cl2可用下列装置制备。
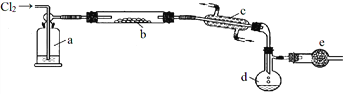
回答下列问题:
(1)写出S2Cl2的电子式________________;装置a中的试剂是________________。
(2)写出实验室制取Cl2的离子反应方程式________________________
(3)装置b中发生反应前,需进行的操作是________________________;
(4)装置e作用是___________________________;
(5)为了获得到纯净的S2Cl2,需要进行的操作名称是________________;
(6)将S2Cl2放入水中会产生沉淀和气体,写出S2Cl2与水反应的化学方程式________________。检验所产生的气体的方法是_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)一定温度下,向1L 0.l mol/L-1 CH3 COOH溶液中加入0.1molCH3COONa固体,溶液中
[c(CH3COO-)·c(H+)]/c(CH3COOH) (填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度之间的一个等式 。
(2)土壤的pH一般在4-9之间。土壤中Na2CO3含量较高,pH可以高达10.5,试用离子方程式解释土壤呈碱性的原因 ,加入石膏(CaSO4 2H2O)可以使土壤碱性降低,有关反应的化学方程式为
(3)常温下在20ml 0.1mo l·L-1 Na2CO3溶液中逐滴加入0.1mol·L-1 HC1溶液40mL,溶液中含碳元素的各种微粒(CO2)因逸出未画出)物质的量分数随溶液pH变化的情况如图所示。
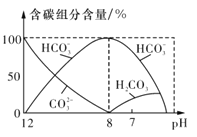
回答下列问题:
①在同一溶液中,H2CO3、HCO3-、CO32- (填“能”或“不能”)大量共存;
②当pH=7时,溶液中含碳元素的主要微粒为 ,溶液中各种离子的物质的量浓度的大小关系
为 ;
③已知在25℃时,CO32-水解反应的平衡常数即水解常数Kh=2×10-4mol·L-1,当溶液中c(HCO3-):c(CO32-)=2:1时,溶液的pH= ;
查看答案和解析>>
科目: 来源: 题型:
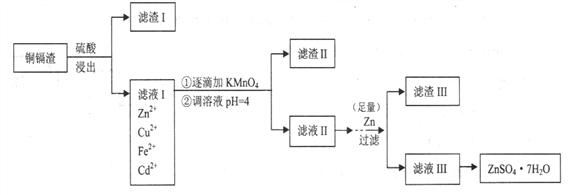
【题目】炼锌厂的铜镉废渣中含有铜、锌、镉、铁、砷等元素,其含量依次减少。对这些元素进行提取分离能减少环境污染,同时制得ZnSO4·7H2O实现资源的再利用。其流程图如下。已知FeAsO4难溶于水;ZnSO4·7H2O易溶于水,难溶于酒精。
金属离子 | Fe3+ | Zn2+ | Mn2+ | Cu2+ | Cd2+ |
开始沉淀pH | 2.7 | 6.5 | 7.7 | 5.2 | 6.9 |
沉淀完全pH | 3.2 | 8.0 | 9.8 | 6.4 | 9.4 |
请回答下列问题:
(1)提高浸出率可以采用的方法是(写出其中一点即可)______________。
(2)滤液I中有少量的AsO33-,若不除去,则AsO33-与Cd反应会产生一种有毒氢化物气体,该气体的分子式为_________。向滤液I中逐滴滴人酸性KmnO4溶液可与AsO33-发生反应生成FeAsO4,完成该反应的离子方程式:_________
___Fe2++___AsO33-+___MnO4-+ □= Mn2++ FeAsO4↓+ □,判断该滴定终点的现象是_______。
(3)流程中②调节pH时可以选用的试剂为________,滤渣Ⅱ的主要成份为________。
(4)常温下Zn(OH)2的溶度积Ksp=_____________________。
(5)制得的ZnSO4 7H2O需洗涤,洗涤晶体时应选用试剂为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com