
科目: 来源: 题型:
【题目】以乙烯为主要原料可以合成乙酸, 其合成路线如下图所示;(部分反应条件和生成物已略去)

(1)乙烯的结构简式___________, 其中官能团的名称是__________ 。
(2)反应Ⅱ的化学方程式是__________,反应类型是__________ 。
(3)乙酸和碳酸钠反应的化学方程式是__________。
(4)下列物质中,可以通过乙烯加成反应得到的是__________(填序号) .
A. CH3CH3 B. CH3CHCl2 C. CH3CH2Br
查看答案和解析>>
科目: 来源: 题型:
【题目】下列推断正确的是 ( )
A. BF3是三角锥形分子
B. NH![]() 的电子式:
的电子式: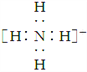 ,离子呈平面形结构
,离子呈平面形结构
C. CH4分子中的4个C—H键都是氢原子的1s轨道与碳原子的p轨道形成的sp σ键
D. 正三价阳离子的电子排布式为1s2 2s2 2p6 3s2 3p6 3d5的元素周期表中位于第Ⅷ族
查看答案和解析>>
科目: 来源: 题型:
【题目】用自来水养鱼时,通常先将自来水晒一段时间后再注入鱼缸,目的是 ( )
A.提高水温 B.增加水中氯气的含量
C .除去水中少量的次氯酸 D.用紫外线杀死水中的细菌
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)写出下列过程的化学方程式:
①CH3COOCH=CH2![]() A
A![]() B
B
聚合反应:______________________________________________
水解反应:_________________________________________________
②甘氨酸与盐酸反应:____________________________
(2)聚碳酸酯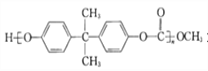 的透光率良好,可制作车、船、飞机的挡风玻璃等。原来合成聚碳酸酯的一种原料是有毒的光气(COCl2),现在改用绿色化学原料碳酸二甲酯
的透光率良好,可制作车、船、飞机的挡风玻璃等。原来合成聚碳酸酯的一种原料是有毒的光气(COCl2),现在改用绿色化学原料碳酸二甲酯![]() 与___________(填字母序号)缩合聚合而成。
与___________(填字母序号)缩合聚合而成。
a.二卤代物 b.二酚类 c.二醛类 d.二烯类
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)氢键作用常表示为“A—H…B”,其中A、B为电负性很强的一类原子,用氢键的表示方法写出HF溶液中存在的所有氢键________________________。
(2)已知某配合物中有如下结构,则N原子的杂化方式为___________,在结构式上用“→”标出配位键。___________
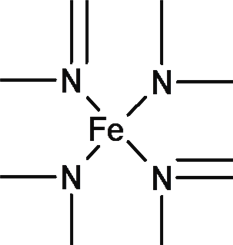
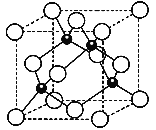
(3)Al和N组成的晶胞结构如下图一所示(“O”表示Al原子):
①则其化学式为_____,Al原子的配位数是___;
②一个N原子周围距离最近且等距的N原子有_____个。
查看答案和解析>>
科目: 来源: 题型:
【题目】海洋是巨大的资源宝库,下面是海水资源综合利用的部分流程图。

(1)从海水中获得粗盐的方法是____________________。
(2)粗盐中含有Ca2+、Mg2+、SO42- 等杂质离子,制取精盐的过程中需依次除去这些离子,所加除杂试剂依次是氢氧化钠溶液、_________________和________________。
(3)①中反应的化学方程式是________________。
(4)③中反应的离子方程式是________________________,生成1molBr2转移电子________mol。
(5)由以上过程可知,Cl2、SO2、Br2的氧化性由强到弱的顺序是________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】A.迄今为止, 化石燃料仍是人类使用的主要能源, 同时也是重要的化工原料。
(1)化石燃料包括煤、石油和_______。化石燃料燃烧时容易引起的环境问题是_______、_______等, 解决这些问题是现今面临的重要挑战。
(2)请将对化石燃料进行综合利用的方法名称填入下表。

_____________________、_________________________、______________________,以上方法中, 属于物理变化的是______( 填序号) 。
(3)由 辛 烷 可 制 得 一 系 列 产 品 : ![]() , 则X 是______; X 在催化剂、加热、加压的条件下可生成乙烯和乙烷, 该反应的化学方程式是____________。
, 则X 是______; X 在催化剂、加热、加压的条件下可生成乙烯和乙烷, 该反应的化学方程式是____________。
(4)碳与水蒸气反应生成水煤气(CO和H2),反应的化学方程式是___________;在此基础上,由水煤气可进一步合成甲醇( CH3OH),则合成甲醇所需的CO 和H2 的体积比是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】【化学一选修3:物质结构与性质】
卤族元素单质与许多物质反应形成多种化合物。请利用所学物质结构与性质的相关知识回答:
(1)写出基态碘原子的价电子排布式___________;
(2)卤族元素的含氧酸中酸性最强的是____(写化学式),该酸根离子的立体构型为_________。
(3)比较下列锗的卤化物的熔点和沸点,分析其变化规律及原因_________。
GeCl4 | GeBr4 | GeI4 | |
熔点/℃ | -49.5 | 26 | 146 |
沸点/℃ | 83.1 | 186 | 约400 |
(4)己知高碘酸有两种形式,化学式分别为H5IO6(![]() )和HIO4,前者为五元酸,后者为一元酸,二者酸性强弱顺序为H5IO6_____ HIO4(填“>”、“<”或“=”)。H5IO6中σ键与π键的个数比为________。
)和HIO4,前者为五元酸,后者为一元酸,二者酸性强弱顺序为H5IO6_____ HIO4(填“>”、“<”或“=”)。H5IO6中σ键与π键的个数比为________。
(5)己知氯元素与第四周期最外层只有1个电子、次外层的所有原子轨道均充满电子的元素M形成的一种化合物的立方晶胞如图所示。
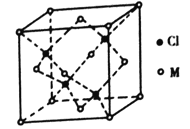
①该化合物的化学式为_______,己知晶胞参数a=0.542 nm,此晶体的密度为_____g/cm3。(写出计算式,不要求计算结果,阿伏加德罗常数为NA)
查看答案和解析>>
科目: 来源: 题型:
【题目】将足量CO2气体通入硅酸钠溶液中,然后加热蒸干,再在高温下充分反应,最后所得的固体物质是
A. Na2SiO3 B. Na2CO3、Na2SiO3 C. Na2CO3、SiO2 D. SiO2
查看答案和解析>>
科目: 来源: 题型:
【题目】天然气中常含有H2S 等有毒气体,下面是以天然气为原料合成氨的工艺流程图。(反应条件已略去)
请根据图回答下列问题。
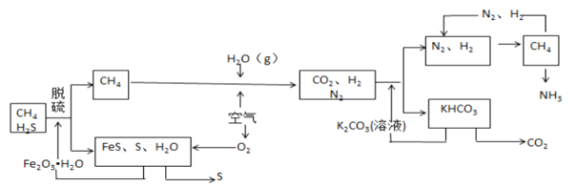
(1)将天然气直接燃烧,产生的有害物质是______________,,引起的环境问题是___________________。
(2)从空气中分离出O2 的方法是______________。
(3)一定条件下发生脱硫反应的化学方程式是_______________________。
(4)上图流程中K2CO3溶液的作用是________________,该反应的离子方程式是_____________。
(5)工业合成氨的化学方程式是_____________,生成的氨气可用于____________(写一条)。
(6)该工艺流程中有多处循环,参与循环的物质有N2、H2、___________和_____________等。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com