
科目: 来源: 题型:
【题目】在四支试管中发生反应:Mg+2HCl=MgCl2+H2↑,生成H2的速率最大的是( )
试管 | 等质量镁的形状 | 盐酸的浓度 (mol·L-1) | 温度(℃) |
A | 条状 | 0.1 | 30 |
B | 条状 | 0.1 | 40 |
C | 粉末状 | 0.1 | 40 |
D | 粉末状 | 0.5 | 40 |
A. AB. BC. CD. D
查看答案和解析>>
科目: 来源: 题型:
【题目】化学在生产和日常生活中有着重要的应用,下列说法不正确的是( )
A. 铁粉和碳粉的混合物可作食品抗氧化剂
B. 共享单车利用太阳能发电完成卫星定位,有利于节能环保
C. 补铁剂与维生素C共同服用可提高补铁效果
D. 光导纤维、醋酸纤维、硝酸纤维都是以纤维素为原料的化工产品
查看答案和解析>>
科目: 来源: 题型:
【题目】化学的实用性表现在它与人们的生活紧密联系。下列常用物质的主要化学成分溶于水后对水的电离有抑制作用的是
A. 明矾 B. 苏打 C. 84消毒液 D. 洁厕灵
查看答案和解析>>
科目: 来源: 题型:
【题目】(12分)下表为长式周期表的一部分,其中的编号代表对应的元素。
① | |||||||||||||||||
② | ③ | ||||||||||||||||
④ | ⑤ | ⑥ | [ | ⑦ | |||||||||||||
⑧ | ⑨ | ⑩ |
请回答下列问题:
(1)表中属于d区元素的是 (填元素符号)。
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子名称为 ;③和⑦形成的一种常见溶剂的化学式为 ,其立体构型为________________。
(3)某元素原子的外围电子排布式为nsnnpn+1,该元素原子的最外电子层上孤电子对数为 ;该元素与元素①形成的最简单分子X属于 分子(填“极性”或“非极性”)。
(4)元素④的第一电离能 元素⑤(选填“>”、“=”、“<”)的第一电离能;元素⑥的电负性 元素⑦(选填“>”、“=”、“<”)的电负性。
(5)元素⑦和⑧形成的化合物的电子式为 。
(6)元素⑩的基态原子核外电子排布式是 。
(7)某些不同族元素的性质也有一定的相似性,如上表中元素②与元素⑤的氢氧化物有相似的性质。请写出元素②的氢氧化物与NaOH溶液反应的化学方程式:
_______________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于某物质是否为电解质的判断正确的是
A. 固体氯化钠不导电,所以氯化钠不是电解质
B. 氯化氢水溶液能导电,所以氯化氢是电解质
C. SO2溶于水能导电,所以SO2是电解质
D. 氨水能导电,所以氨水是电解质
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关乙烯的反应中属于加聚反应的是( )
A. 在空气中完全燃烧
B. 在一定条件下生成聚乙烯
C. 使溴的四氯化碳溶液褪色
D. 使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目: 来源: 题型:
【题目】(2017·黑龙江省牡丹江市第一高级中学月考)用98%的浓硫酸(ρ=1.84 g/cm3)配制1 mol/L稀硫酸100 mL。
(1)实验操作:
a.用100mL量筒量取98%的浓硫酸___________mL;
b.选取对应规格的容量瓶,洗涤,检查是否漏液,将稀释并冷却至室温的硫酸溶液沿玻璃棒转移到此容量瓶中;
c.用少量蒸馏水洗涤小烧杯和玻璃棒2~3次,并将洗涤液转移到容量瓶中;
d.在小烧杯内稀释浓硫酸,稀释时要用玻璃棒不断搅拌;
e.向容量瓶中直接加蒸馏水至离刻度线1~2 cm处;
f.盖上容量瓶瓶塞,摇匀;
g.用胶头滴管小心加蒸馏水至刻度线;
h.将配制好的溶液转移入含少量蒸馏水的试剂瓶中贮存备用。
(2)实验分析:
①正确的操作步骤是__________________________________________________(填序号)。
②此实验中玻璃棒的作用是__________________________________________________。
③实验操作中有两处错误,这两处错误是:________________________、_________________________。
(3)下列操作对所配溶液的浓度有何影响?(填“偏高”“偏低”或“无影响”)
①量取浓硫酸的量筒用蒸馏水洗涤两次,并将洗涤液转入容量瓶中______________。
②定容时俯视容量瓶刻度线________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】碱式碳酸铜是一种用途广泛的化工原料,明矾是种常见的净水剂,某校化学兴趣小组探究将一废弃矿石进行处理制备碱式碳酸铜和明矾,从而实现变废为宝。经查资料:该矿石成分为:Al2Fe4CuSi2O13,该化学小组制定工艺流程如下:

己知:Cu2+溶于足量的浓氨水中可形成铜氨溶液:Cu2++4NH3·H2O![]() Cu(NH3)42++4H2O
Cu(NH3)42++4H2O
回答下列问题:
(1)将Al2Fe4CuSi2O13改写成氧化物形式___________;
(2)为了步骤②提高酸浸速率,可采取措施有________,_________(任写两种);
(3)写出步骤⑥的离子方程式__________;
(4)用从滤渣2到明矾需先后加入_____、____两种试剂(按使用顺序填写化学式);
(5)在步骤⑦中,若先加K2CO3溶液,后加KOH溶液,则易发生
CuCO3(s)+2OH-(aq) ![]() Cu(OH)2(s)+CO32-(aq),则该反应平衡常数为:______。(已知:Ksp(CuCO3=2.4×10-10,Ksp(Cu(OH)2=2.2×10-20)。
Cu(OH)2(s)+CO32-(aq),则该反应平衡常数为:______。(已知:Ksp(CuCO3=2.4×10-10,Ksp(Cu(OH)2=2.2×10-20)。
(6)为了检验该碱式碳酸铜纯度,该小组称取25g样品,加入到100mL 3mol/L的盐酸中进行溶解。充分反应后,微热排除CO2,冷却后取出10mL,滴加2滴甲基橙,然后用2mol/L标准KOH溶液进行滴定,共用去5mL。则样品的纯度为_________
查看答案和解析>>
科目: 来源: 题型:
【题目】有关下图装置的叙述中,正确的是
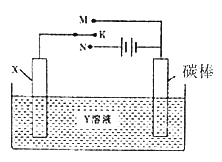
A. 若X为铁棒, Y为NaCl溶液, 开关K置于M处, 可减缓铁的腐蚀, 这种方法称为外接电源的阴极保护法
B. 若整个装置为电解精炼铜的装置,则X为粗铜,Y为硫酸铜溶液,开关K置于N处。且电解过程中硫酸铜溶液浓度不变
C. 若X为碳棒, Y为氯化铜溶液, 开关K置于N处, 当产生11.2L气体时,右侧碳棒质量增加6.4g
D. 若X为碳棒, Y为氯化钠溶液, 开关K置于N处, 当电路中有0.01mol电子流过时,假设此时该溶液为100mL,则常温下其pH为13
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com