
科目: 来源: 题型:
【题目】O2、CH4和CO的混合气体在标准状况下的密度为1.25g/L,这三种气体的物质的量之比不可能为( )
A. 3:1:2 B. 6:2:3 C. 3:4:6 D. 9:3:7
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关实验的说法正确的是
A. 用镊子夹住pH试纸蘸取NH4Cl溶液测溶液的pH
B. 洗涤沉淀时将沉淀转移至烧杯中,进行冲洗后过滤,并重复2-3次
C. 测定中和热的实验中应缓慢地将碱溶液倒入酸中,防止液体飞溅
D. 使用滴定管准确量取一定体积的溶液时,不能将滴定管内液体放空
查看答案和解析>>
科目: 来源: 题型:
【题目】I.配制250mL0.5mol/L的NaOH溶液,所需的仪器有烧杯、玻璃棒、托盘天平、胶头滴管和_______。定容时俯视观察刻度线,其结果_______。(填“偏大”、“偏小”、或“不变”)
Ⅱ.实验室用加热固体氯化铵和氢氧化钙的混合物制取氨气,反应的化学方程式是_______;所制得的气体中常含有少量杂质气体,为了得到纯净的氨气并加以检验,请在下列装置或试剂中,根据要求作出合适选择,并将对应选择的装置编号字母填入表中的空格处:
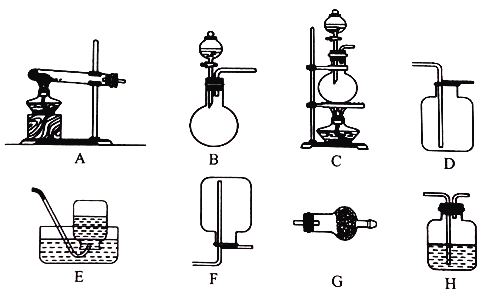
试剂:a. NaOH溶液 b.澄清石灰水 c.浓硫酸 d.饱和NaHCO3溶液 e.碱石灰
f.品红溶液 g.湿润的红色石蕊试纸
制取气体 | 杂质气体 | 制取气体的 发生装置 | 收集装置 | 净化装置中 所用的试剂 | 检验制得的气体 所用试剂 |
NH3 | H2O(g) | _______ | F | e | _______ |
查看答案和解析>>
科目: 来源: 题型:
【题目】从烷烃(CnH2n+2),烯烃(CnH2n),二烯烃(CnH2n--2)的通式分析,得出碳氢原子的个数与分子中所含双键有一定关系,某种烃的分子式为CxHy,其中所含双键数目最多为
A.y/2 B.(y-x)/2 C.(y+2-x)/2 D.(2x+2-y)/2
查看答案和解析>>
科目: 来源: 题型:
【题目】某有机物的名称是2,2,3,3-四甲基戊烷,下列有关其结构简式的书写正确的是
A.(CH3)3CCH(CH3)2 B.(CH3)3CCH2C(CH3)2
C.(CH3)3CC(CH3)2CH2CH3 D.(CH3)3CC(CH3)3
查看答案和解析>>
科目: 来源: 题型:
【题目】本题为《化学反应原理(选修4)》
(1)t℃时,将2molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生如下反应:2SO2 (g)+O2(g)![]() 2SO3(g),△H=-196.6kJ·mol-1。2min时反应达到化学平衡状态,此时测得反应物O2还剩余0.8mol,填写下列空白:
2SO3(g),△H=-196.6kJ·mol-1。2min时反应达到化学平衡状态,此时测得反应物O2还剩余0.8mol,填写下列空白:
① 从反应开始到化学平衡状态,生成SO3的平均反应速率为_____;此时反应物O2的转化率是___________;
② 下列叙述能证明该反应已达到化学平衡状态的是______(填标号,下同);
A.容器内压强不再发生变化
B. SO2的体积分数不再发生变化
C. 容器内气体原子总数不再发生变化
D. 相同时间内消耗2nmol SO2的同时消耗n molO2
③t℃时,若将4mol SO2和2mol O2的混合气体通入上述恒温恒容密闭容器中,反应重新达到平衡时SO2的转化率与① 比较_______(填“增大”、“不变”或“减小”)。
(2)今有常温下的下列溶液:
①0.1mol/LFeC13 溶液呈_______(填“酸性”、“中性”或“碱性”);
② 实验测得0.1mol/LNaHCO3溶液pH>7,则NaHCO3的电离程度_______水解程度(填“大于”、“等于”或“小于”)。
③ 在0.10mol/L硫酸铜溶液中加入氢氧化钠稀溶液充分反应有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=_________(已知Ksp[Cu(OH)2]=2.2×10-2O)。
(3)①事实证明,原电池中发生的反应通常是放热反应。利用下列反应可以设计为原电池的是_________;
A. C(s)+H2O(g)=CO(g)+H2(g) △H>0
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H<0
C.2H2(g)+O2(g)=H2O(l)△H<0
② 以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其正极反应式是________;
③ 电解原理在工业上有着广泛的应用。下图所示电解池中,a为CuSO4溶液,X和Y为惰性电极,则Y电极附近溶液的pH变化是_______(填“增大”“不变”或“减小”)。
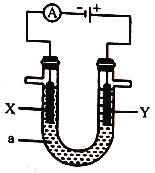
查看答案和解析>>
科目: 来源: 题型:
【题目】用下列实验装置进行相应的实验,能够达到实验目的的是( )
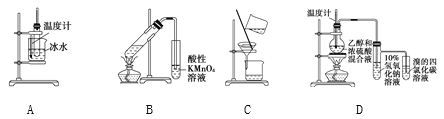
A. 实验室制取少量硝基苯 B. 证明溴乙烷、NaOH、乙醇溶液共热生成乙烯
C. 分离乙酸乙酯、碳酸钠和水的混合物 D. 证明乙醇浓硫酸共热生成乙烯
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关反应热的叙述中正确的是( )
①下表数据可以计算出 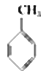 (g)+3H2(g)→
(g)+3H2(g)→ 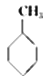 (g)的反应热;
(g)的反应热;
共价键 | C﹣C | C═C | C﹣H | H﹣H |
键能/(kJmol﹣1) | 348 | 610 | 413 | 436 |
②已知2H2(g)+O2(g)═2H2O(g)△H=﹣483.6kJmol﹣1, 则氢气的燃烧热为△H=﹣241.8kJmol﹣1
③由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定
④X(g)+Y(g)═Z(g)+W(s)△H>0,恒温恒容条件下达到平衡后加入X,上述反应的△H增大
⑤由盖斯定律,推知在相同条件下,金刚石或石墨燃烧生成1molCO2固体时,放出的热量相等;
⑥25℃,101kPa时,1mol碳完全燃烧生成CO2所放出的热量为碳的燃烧热.
A. ①②③④ B. ③④⑤ C. ④⑤ D. ⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】某混合气体中可能含有Cl2、O2、SO2、NO、NO2中的两种或多种气体。现将此无色透明的混合气体通过品红溶液后,品红溶液褪色,把剩余气体排入空气中,很快变为红棕色。对于原混合气体成分的判断中正确的是 ( )
A. 肯定有SO2和NO B. 肯定没有Cl2和NO2,无法判断是否有O2
C. 可能有Cl2和O2 D. 肯定有NO和Cl2,一定没有O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com