
科目: 来源: 题型:
【题目】现有一份NaOH固体样品,里面混有少量的Na2CO3、NaCl杂质,某同学用中和滴定的方法来测定NaOH的纯度。其操作如下:
①称取a g样品放入锥形瓶中,加水,振荡,使固体充分溶解。
②向该溶液中加入足量的BaCl2溶液,使CO![]() 沉淀完全。
沉淀完全。
③向所得混合液中滴入2~3滴酚酞指示剂,然后用c mol·L-1的盐酸进行滴定。
④当反应达终点时,测得消耗盐酸的体积为V mL。
⑤计算样品的纯度。
试回答下面的问题
(1)滴定终点时溶液颜色如何变化:_____________________________________________。
(2)第②步中生成的BaCO3沉淀未过滤出来就直接用盐酸滴定,是否会对NaoH的含量测定造成影响(填“是”或“否”)___________,理由是_______________________________。
(3)第②步中生成的BaCO3沉淀未过滤出来就直接用盐酸滴定,能否改用甲基橙作指示剂(填“能”或“否”)__________。若改用甲基橙作指示剂则实验结果_______________(填“偏大”、“偏小”或“不变”)。
(4)根据上述实验数据,写出计算NaOH纯度的表达式
__________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】高炉炼铁的基本反应之一是:FeO(s)+CO(g) ![]() Fe(s)+CO2(g) ;△H>0。其平 衡常数K=
Fe(s)+CO2(g) ;△H>0。其平 衡常数K=![]() ,且K(1100℃)=0.263。
,且K(1100℃)=0.263。
(1) 温度升高,平衡常数K的值______,高炉内CO2和CO的体积比值______(填 “增大”、“减小”、“不变”)
(2)在1100℃时,测得某高炉中,c(CO2)=0.025mol/L,c(CO)=0.1mol/L。这种情 况下,该反应是否处于平衡状态?答:_____(填“是”、“否”)。此时,化学反应速率是V(正)__________V(逆)(填“大于”、“等于”、“小于”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各项中,对所描述内容的相关分析不正确的是
选项 | 描述 | 分析 |
A | “青蒿一握,以水二升渍,绞取计” | 其中涉及到了萃取过程 |
B | 炼丹家制硫酸时用“炼石胆(胆矾)取其精华” | 其中利用了分解反应 |
C | 古代染坊常用某种碱剂来精炼丝绸 | 碱剂不可能为烧碱 |
D | “古剑‘沈卢’,以剂钢为刃” | 剂钢的成分为纯铁 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】巧妙的实验设计有助于更好地解决问题。下列装置不能达到实验目的的是
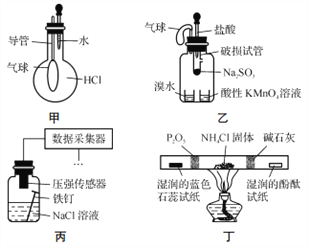
A. 用装置甲验证HCl气体易溶于水
B. 用装置乙验证SO2具有漂白性
C. 用装置丙采集到的压强数据判断铁钉发生析氢腐蚀还是吸氧腐蚀
D. 用装置丁检验NH4Cl分解产生的气体
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,电解质溶液中的下列关系式不正确的是
A. 已知A-+H2B(过量)==HA+HB-,则结合H+的能力:HB-<A-<B2-
B. 在0.1mol·L-1的氨水中滴加0.1 mol·L-1盐酸,恰好完全中和时, c(NH4+)+c(NH3 H2O)=0.05 mol·L-1
C. 将c mol·L-1的醋酸溶液与0.02 mol·L-1NaOH溶液等体积混合后溶液恰好呈中性,用含c的代数式表示CH3COOH的电离常数ka=![]()
D. 将0.2 mol·L-1盐酸与0.1 mol·L-1的KAlO2溶液等体积混合,溶液中离子浓度由大到小的顺序:c(Cl-)> c(K+)> c(Al3+)> c(H+)> c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图示与对应的叙述不相符合的是
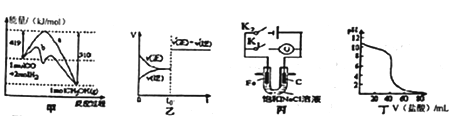
A. 图甲表示工业上用CO生产甲醇的反应CO(g)+2H2(g) ![]() CH3OH(g)。该反应的 △H=-91 kJ·mol-1
CH3OH(g)。该反应的 △H=-91 kJ·mol-1
B. 图乙表示己达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改 变的条件可能处加入催化剂
C. 图丙中若K1闭合,石墨棒周围液pH逐渐升高;若K2闭合,电路中通过0.002NA 个电子时,两极理论上共产生0.002mol气体
D. 图丁表示盐酸滴加0.1 mol·L-1NaOH溶液得到的滴定曲线,该实验的指示剂最好选取酚酞
查看答案和解析>>
科目: 来源: 题型:
【题目】Fe、A1、Cu是生活中常用的金属。
(1)基态Cu原子核外电子排布式为_____________,基态Fe2+核外有_________个未成对电子。
(2)①re、Al、Cu三种元素第一电离能由高到低的顺序为___________________。
②Mn和Fe的部分电离能数据如下表:
元素 | Mn | Fe | |
电离能/kJ mol-1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 |
根据上表数据,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是_____________。
(3)铁可形成多种配合物,如[Fe(CN)6]4-、Fe(CO)5等,lmol Fe(CN)43-中含有σ键的数目为________;Fe(CO)5熔点为-20.5℃,沸点为103℃:易溶于CCl4,据此可以判断Fe(CO)3晶体属于________ (填晶体类型)。
(4)下列变化过程中,破坏的力的作用类型相同的是_____________;(填字母代号)。
A.铝气化 B.A1C13溶于水 C.加热使铜熔化 D.熔融NaC1
(5)Fe能与N形成一种磁性材料,其晶胞结构如图所示:
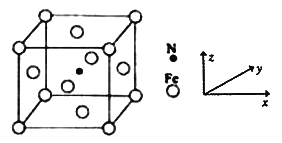
①该磁性材料的化学式为__________________;
②Fe原子的坐标参数为(![]() ,
, ![]() ,0)、(
,0)、(![]() ,0,
,0, ![]() )、________、(0,0,0),N原子的坐标参数为_______。
)、________、(0,0,0),N原子的坐标参数为_______。
③已知该晶体的晶胞参数α pm,列出其密度表达式为_________g cm-3(用含α的式子表示,只列式子,不作计算。)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组热化学方程式中,化学反应的ΔH前者大于后者的是
①C(s)+O2(g)===CO2(g) ΔH1 C(s)+![]() O2(g)===CO(g) ΔH2
O2(g)===CO(g) ΔH2
②S(s)+O2(g)===SO2(g) ΔH3 S(g)+O2(g)===SO2(g) ΔH4
③H2(g)+![]() O2(g)===H2O(l) ΔH5 2H2(g)+O2(g)===2H2O(l) ΔH6
O2(g)===H2O(l) ΔH5 2H2(g)+O2(g)===2H2O(l) ΔH6
④CaCO3(s)===CaO(s)+CO2(g) ΔH7 CaO(s)+H2O(l)===Ca(OH)2(s) ΔH8
A. ① B. ④ C. ②③④ D. ①②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com