
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列说法正确的是
A. 1mol乙烯分子中含有共用电子对数为6NA
B. 常温常压下,32gO2、O3的混合物含有Na个氧原子
C. 标准状况下,2.24 L CH2Cl2含有的分子数等于0.1 NA
D. 7.1 g C12与足量NaOH溶液反应转移0.2×6.02×1023个电子
查看答案和解析>>
科目: 来源: 题型:
【题目】运用相关原理,回答下列各小题:
I.已知:NaHSO4在水中的电离方程式为NaHSO4=Na++H++SO42- .
(1)常温下,pH=5的NaHSO4溶液中水的电离程度______________(填“>”、”=”或“<”)pH=9的氨水中水的电离程度。
(2)等体积等物质的量浓度的NaHSO4与氨水混合后,溶液呈酸性的原因为:______________(用离子方程式表示);若一定量的NaHSO4溶液与氨水混合后,溶液pH=7,则c(Na+)+c(NH![]() )______________c(SO42-)(填“>”、“=”或“<”);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的pH______________7(填“>”、”=”或“<”)。
)______________c(SO42-)(填“>”、“=”或“<”);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的pH______________7(填“>”、”=”或“<”)。
(3)将分别含有MnO![]() 、Fe3+、Fe2+、I- 的四种溶液混合,调节溶液的pH,使pH=1,充分反应后:若I- 离子有剩余,上述四种离子在溶液中还存在的有______________,一定不存在的是______________。
、Fe3+、Fe2+、I- 的四种溶液混合,调节溶液的pH,使pH=1,充分反应后:若I- 离子有剩余,上述四种离子在溶液中还存在的有______________,一定不存在的是______________。
II.在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl,利用Ag+与CrO42生成砖红色沉淀,指示到达滴定终点。当溶液中Cl恰好沉淀完全(浓度等于1.0×105 mol·L1)时,溶液中c(Ag+)为________________mol·L1,此时溶液中c(CrO42)等于______________mol·L1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×1012和2.0×1010)。
查看答案和解析>>
科目: 来源: 题型:
【题目】对于可逆反应4 NH3(g)+5O2(g)![]() 4NO(g)+6 H2O(g),下列叙述正确的是
4NO(g)+6 H2O(g),下列叙述正确的是
A. NH3和H2O化学反应速率关系是2v正(NH3)= 3v正(H2O)
B. 达到化学平衡时,4v正(O2)= 5v逆(NO )
C. 达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大
D. 若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态
查看答案和解析>>
科目: 来源: 题型:
【题目】I、二氧化硫是常用的工业原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。
已知:硫酸生产中,将SO2催化氧化成SO3的化学方程式为:2SO2+O2![]() 2SO3。将2.0mol SO2和1.0mol O2置于10L密闭容器中,在300℃和500℃条件下得到如图所示图象 回答下列问题:
2SO3。将2.0mol SO2和1.0mol O2置于10L密闭容器中,在300℃和500℃条件下得到如图所示图象 回答下列问题:
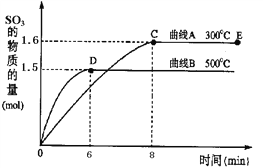
①300℃时,平衡常数K=________,升高温度,K值______(填“增大”、“减小”或“不变”)。
②在500℃时,从反应开始到平衡,氧气的平均反应速率v(O2)=______________。
③在其他条件不变的情况下,对处于E点的反应体系,体积压缩到原来的1/2,下列有关该体系的说法正确的是________。
A.氧气的浓度减少 B.正反应速率加快,逆反应速率也加快
C.SO3的物质的量增加 D.重新平衡时,n(O2)/n(SO3)增大
④已知2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-196.64kJ·mol-1,在一定温度下,向一固定容积的密闭容器中通入2molSO2、1molO2,达到平衡时放出热量为Q1kJ,在同样条件下,向该容器中通入2molSO3,达到平衡时,吸收热量为Q2kJ,则Q1和Q2的关系为_________________。
2SO3(g) ΔH=-196.64kJ·mol-1,在一定温度下,向一固定容积的密闭容器中通入2molSO2、1molO2,达到平衡时放出热量为Q1kJ,在同样条件下,向该容器中通入2molSO3,达到平衡时,吸收热量为Q2kJ,则Q1和Q2的关系为_________________。
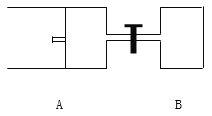
II、如图所示,向A中充入 1mol X和1mol Y,向B中充入 2mol X和2mol Y,起始时VA=VB=aL。在相同温度和有催化剂存在的条件下,两容器各自发生下列反应:X+Y![]() 2Z+W;(四物质均为气体)。达到平衡时VA=1.2a L,试回答:(A在的活塞可移动)A、B中X的转化率αA ______αB(填“>、=、<”)。
2Z+W;(四物质均为气体)。达到平衡时VA=1.2a L,试回答:(A在的活塞可移动)A、B中X的转化率αA ______αB(填“>、=、<”)。
III、现有反应:mA(g)+nB(g)![]() pC(g),达平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)若加入B(体积不变),则A的转化率______。
(2)若升高温度,则平衡时B、C的浓度之比![]() 将________。
将________。
(3)若加入催化剂,平衡时气体混合物的总物质的量__________。
(4)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色________,
而维持容器内压强不变,充入氖气时,混合物颜色______(填“变深”、“变浅”或“不变”)。
(5)在固定容积的密闭容器中能说明反应己达平衡状态的是______________。
A.浓度pc(B)=nc(C) B.容器内压强保持不变
C.pv逆(B)=n v正(C) D.容器内的密度保持不变
查看答案和解析>>
科目: 来源: 题型:
【题目】下图甲是利用一种微生物将废水中尿素[CO(NH2)2]的化学能直接转化为电能,并生成环境友好物质的装置,同时利用此装置在乙中的铁上镀铜。卞列说法中不正确的是
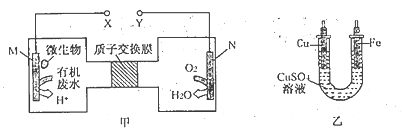
A. 铜电极应与Y电极相连接
B. H+通过质子交换膜由左向右移动
C. 当N电极消耗0. 25 mol气体时,则铁电极增重 16 g
D. M电极的反应式为:CO(NH2)2+ H2O-6e- =CO2↑+N2↑+6H+
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向20mL 0.2mol/L H2A溶液中滴加0.2 mol/L NaOH溶液,含A元素的有关微粒物质的量变化如下图所示。根据图示判断,下列说法正确的是

A. H2A在水中的电离方程式是:H2A== H++HA-;HA-![]() H++A2-
H++A2-
B. 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大
C. 当V(NaOH)=30mL时,溶液中存在以下关系:2c(H+)+ c(HA-)+ 2c(H2A)=c(A2-)+2c(OH-)
D. 当V(NaOH)=20mL时,溶液中各粒子浓度的大小顺序为:c(Na+)>c(HA-)>c(H+)>c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子在指定溶液中一定能大量共存的是
A.能使甲基橙变红的溶液中:Fe2+、Al3+、NO![]() 、Cl-
、Cl-
B.在pH=12的溶液中:Na+、AlO![]() 、NO
、NO![]() 、S2-
、S2-
C.室温下,由水电离的c(H+)=10-10mol/L的溶液中:Cl-、HCO![]() 、NO
、NO![]() 、NH
、NH![]()
D.加入Mg能放出H2的溶液中:Mg2+、NH![]() 、ClO-、K+
、ClO-、K+
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 二氧化锰和浓盐酸反应:MnO2+4H++4Cl- ![]() Mn2++2Cl2+2H2O
Mn2++2Cl2+2H2O
B. 往NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
C. 往酸性碘化钾溶液中滴加适量的双氧水:2H++2I-+H2O2=I2↑+2H2O
D. 向NaHSO4溶液中滴加Ba(OH)2溶液反应至中性:H++SO42+ Ba2++OH-=BaSO4↓+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】向2 L的密闭容器中加入一定量的A、B、C三种气体,一定条件下发生反应,各物质的物质的量随时间变化如图甲所示。图乙为t2时刻后改变条件平衡体系中反应速率随时间变化的情况,且4个阶段所改变的外界条件均不相同,已知t3——t4阶段为使用催化剂。观察下图,回答下列问题:
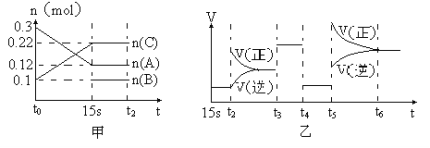
(1)甲图中从反应至达到平衡状态,生成物C的平均反应速率为 。
(2)乙图中t2时引起平衡移动的条件是 ,t5时引起平衡移动的条件是 。
(3)乙图中表示平衡混合物中,在这4个阶段中C的含量最高的一段时间是 。
(4)该反应的化学方程式可以表示为: ,正反应为 (填“放热”或“吸热”)反应。
(5)反应开始时加入的B的物质的量为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与生产、生活、社会密切相关。下列有关说法正确的是
A. 点燃爆竹后,硫燃烧生成SO3
B. 中国古代利用明矾溶液的酸性清除铜镜表明的铜锈
C. 服用阿司匹林出现水杨酸反应时,用NaOH溶液解毒
D. 使用含钙离子浓度较大的地下水洗衣服,肥皂去污能力增强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com