
科目: 来源: 题型:
【题目】某羧酸酯A的分子式为C6H12O2,1mol该酯在酸性条件下完全水解可得到1molB和1molC,B在一定条件下可氧化生成C,符合条件的A有
A. 1种 B. 2种 C. 3种 D. 4种
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E各物质的关系如下图所示:

已知:X能使湿润的红色石蕊试纸变蓝。
(1)无色液体A是_____,A与B反应的化学方程式是____________。
(2)由X转化为N2的化学方程式为______________。
(3)白色固体C的化学式为 _____。由D转化为E的离子方程式为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】“84消毒液”能有效杀灭甲型H1N1病毒,某同学购买了一瓶“威露士”牌“84消毒液”,并查阅相关资料和消毒液包装说明得到如下信息:“84消毒液”:含25%NaClO、1 000 mL、密度1.192 g·cm3,稀释100倍(体积比)后使用。请根据以上信息和相关知识回答下列问题:
(1)该“84消毒液”的物质的量浓度为________mol·L1。
(2)该同学取100 mL“威露士”牌“84消毒液”稀释后用于消毒,稀释后的溶液中c(Na+)=________mol·L1。
(3)一瓶“威露士”牌“84消毒液”能吸收空气中________L的CO2(标准状况)而变质。(已知:CO2+2NaClO+
H2O![]() Na2CO3+2HClO)
Na2CO3+2HClO)
(4)该同学参阅“威露士”牌“84消毒液”的配方,欲用NaClO固体配制480 mL含25%NaClO的消毒液。下列说法正确的是________。
A.如上图所示的仪器中,有四种是不需要的,还需一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干才能用于溶液配制
C.利用购买的商品NaClO来配制可能导致结果偏低
D.需要称量的NaClO固体质量为143 g
查看答案和解析>>
科目: 来源: 题型:
【题目】苯甲酸(C6H5COOH式量:122,熔点122.4℃,密度为1.2659g·cm-3)是一种一元有机弱酸,微溶于水易溶于乙醇。实验室中由甲苯(式量:92,密度为0.8669 g·cm-3)制备苯甲酸的实验如下:

第一步:将18.4g甲苯和硫酸酸化的KMnO4溶液置于如图的三颈瓶中,加热保持反应物溶液温度在90℃左右至反应结束。
第二步:将反应后混合液过滤,滤液用浓盐酸酸化,抽滤得粗产品。
第三步:粗产品用水洗涤2到3次,干燥称量得固体23.4g。
请回答下列问题:
(1)仪器甲的名称为_________________。
(2)第一步发生反应的化学方程式为____________________________。
(3)第二步中抽滤的优点是____________________________________。
(4)第三步证明洗涤干净的方法是_________________________________;
干燥的最佳方法是________ (填代号)
a.空气中自然风干b.沸水浴上干燥c.直接加热干燥
(5)由以上数据知苯甲酸的产率为_____________。
(6)某学生为测定苯甲酸的电离平衡常数设计实验如下:常温下,将a mol苯甲酸和b mol KOH混合加水形成2L溶液,测得溶液的pH=7,请用含a、b的代数式表示出苯甲酸的Ka=____________,该溶液中的离子浓度大小关系为____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】铁锅是有益于人类健康的理想炊具,其主要原因( )
A.价格便宜,不易生锈B.铁具有银白色光泽,导电性好
C.烹饪的食物中留有人体需要的铁元素D.传热慢,保温性能好
查看答案和解析>>
科目: 来源: 题型:
【题目】氮和钠可形成化合物Na3N,它能与水剧烈反应产生NH3,下列叙述正确的是:( )
A. Na3N与水的反应是氧化还原反应
B. Na3N 是共价化合物
C. Na3N中4个离子均满足最外层8电子稳定结构
D. Na3N中钠离子半径大于氮离子半径
查看答案和解析>>
科目: 来源: 题型:
【题目】标准状况下,在体积相同的三个圆底烧瓶中分别盛满NH3、HCl和NO2气体,并分别倒立在水槽里,充分溶解后圆底烧瓶内三种溶液物质的量浓度之比为(设圆底烧瓶内液体未扩散到水槽里) ( )
A. 1∶1∶1 B. 2∶2∶3
C. 3∶3∶2 D. 2∶2∶1
查看答案和解析>>
科目: 来源: 题型:
【题目】金属铁盐或其氧化物在生产生活和科学实验中应用广泛。
(1)一定条件下Fe2O3与甲烷反应制取纳米级铁,同时生成CO和H2。
已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-27.6kJ/mol
CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.4kJ/mol
CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41.0kJ/mol
①反应Fe2O3(s)+3 CH4(g)![]() 2Fe(s)+3CO(g) +6H2(g)的△H______0(填“>”、“<”或“=”)
2Fe(s)+3CO(g) +6H2(g)的△H______0(填“>”、“<”或“=”)
②若该反应在5L的密闭容器中进行,1min后达到平衡,测得体系中固体质量减少0.96g。则该段时间内CO的平均反应速率为__________。
③若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是______(选填序号)
a.c(CH4)=c(CO)
b.固体的总质量不变
c.v(CO)与v(H2)的比值不变
d.混合气体的平均相对分子质量不变
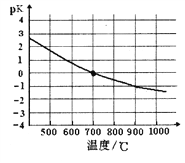
④该反应的化学平衡常数的负对数pK随反应温度T的变化曲线如下图。试用平衡移动原理解释该曲线的变化规律:______________________。若700℃时测得c平衡(H2)=1.0mol·L-1,则CH4的转化率为_________。
(2)菱铁矿的主要成分是:FeCO3,实验室中可以通过FeSO4与NaHCO3溶液混合制得FeCO3,有关反应的离子方程式为:____________________。已知Ksp[FeCO3]=3.2×10-11,H2CO3的Ka1=4.30×10-7,Ka2=5.61×10-11。试通过以上数据简要计算说明该反应能进行的原因_____________________。
(3)Na2FeO4是一种高效净水剂,工业上以Fe为阳极,NaOH为电解质溶液进行电解制备, 写出阳极电极反应式:_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com