
科目: 来源: 题型:
【题目】某化学兴趣小组为了制取并探究氨气性质,按下列装置(部分夹持装置已略去)进行实验。
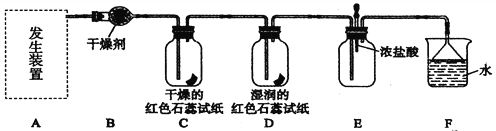
【实验探究】
(1)实验室制取氨气应选用下图中________发生装置进行实验,反应的化学方程式为
_________________________

(2)B装置中的干燥剂可选用________(填“碱石灰”或“浓硫酸”)。
(3)气体通过C、D装置时,试纸颜色会发生变化的是____(填“C”或“D”)。
(4)当实验进行一段时间后,挤压E装置中的胶头滴管,滴入1~2滴浓盐酸,可观察到的现象是____________________________________________________________。
(5)F装置中倒置漏斗的作用________________________________________________。
(6)某同学用右图所示装置进行氨气的性质实验,根据烧瓶内产生红色喷泉的现象,说明氨气具有________性质(填序号)。
a.还原性 b.极易溶于水 c.与水反应生成碱性物质
(7)氨气的用途很广。如可用氨气处理二氧化氮:8NH3 + 6NO2 ==7N2 + 12H2O
该反应中氨气体现________(填“氧化性”或“还原性”)。请你列举出氨气的另一种用途_____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关物质分类的说法正确的是
A. 胶体与溶液的本质区别是分散质粒子直径的大小
B. SiO2既能与NaOH 溶液反应,又能与氢氟酸反应,是一种两性氧化物
C. CO2 的水溶液可以导电,所以CO2 是电解质
D. H2SO4、NaOH、K2CO3 在水溶液中均能电离,它们均为离子化合物
查看答案和解析>>
科目: 来源: 题型:
【题目】W、X、Y、Z、M五种元素位于周期表中前四周期。W元素的一种核素原子核内没有中子;X、Y元素最外层电子排布式均可表示为nsnnpm,其中X元素第一电离能在本周期中最大,Y元素第一电离能和电负性在本周期中均居第三位;Z元素在周期表中周期序数等于族序数且为奇数;M位于元素周期表ds区,最外层只有1个电子。
(1)W、Y形成的化合物_________(填序号)。
①可能只含有离子键②可能只含有共价键③可能既含有离子键又含有共价键
(2)Y基态原子的价电子轨道表示式为________,与Y3-互为等电子体的分子是_______。
(3)将X充入灯管中通电后发出红光,试用电子跃迁理论解释:__________________。
(4)Z单质溶于强碱溶液生成的阴离子中心原子杂化方式为______,该离子空间构型为_________。
(5)M是第四周期最重要的过渡元素之一,其单质及化合物具有广泛用途。已知M与W形成的化合物晶体结构如图所示,该化合物的密度为ρg·m-3伏伽德罗常数的值为NA,则WM最近距离距离为________cm(含NA和ρ的式子表示)。

查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是
A. 石油裂解可制取乙烯、丙烯 B. 以淀粉为原料可制取乙酸乙酯
C. 植物油氢化过程中发生了加成反应 D. 煤经过气化和液化等物理变化可以转化为清洁燃料
查看答案和解析>>
科目: 来源: 题型:
【题目】阿伏加德罗常数的值为NA,下列说法确的是
A. 标准状况2.24LCCl4含有共价键数为0.4NA
B. 1LpH=1的H3PO4溶液中H+的数目为0.1NA
C. 1molN2与6molH2反应生成的NH3分子数为2NA
D. 钾与水反应生成0.1molO2时转移电子数为0.1NA
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,A处通入氯气,关闭弹簧夹B时,C处红色布条无明显的变化,打开弹簧夹B时,C处红色布条逐渐褪色。由此作出的判断正确的是( )
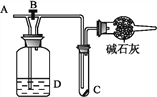
A. D中不可能是浓硫酸
B. D中可以是水
C. 通入的氯气中含有水蒸气
D. D中可以是饱和食盐水
查看答案和解析>>
科目: 来源: 题型:
【题目】如下图所示:
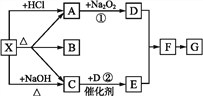
图中每一方格表示有关的一种反应物或生成物,其中A、C为无色气体,请填写下列空白:
(1)物质X可以是______,C是_________, F是______。
(2)反应①的化学方程式是_________,反应②的化学方程式是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分,根据表中列出的10种元素,回答下列问题。
族 周期 | I A | II A | III A | IV A | V A | VI A | VII A | 0 |
2 | C | N | O | Ne | ||||
3 | Na | Mg | Al | Si | S | Cl |
(1)O和S中,原子半径较大的是________;(填元素符号或化学,以下同)
(2)CH4和NH3中,热稳定性较强的是________;
(3)新制氯水有漂白作用,是因为其中含有________;
(4)元素最高价氧化物对应水化物中,碱性最强的是________,存放该溶液的试剂瓶盖不能用玻璃塞,请写出该反应的离子方程式_____________________________________;元素最高价氧化物对应水化物中,两性氢氧化物是__________;
(5)为了除去甲烷混有的少量乙烯可用________试剂;
(6)乙酸与乙醇在一定条件下可制备具有特殊香味的物质,请写出该反应的化学方程式____________________;试验中用到了饱和碳酸钠溶液,其作用有____________________。
(7) 在2 L的密闭容器中,充入2 mol N2和3 mol H2,在一定条件下发生反应,3 s后测得N2为1.9 mol,则以H2的浓度变化表示的反应速率为__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com