
科目: 来源: 题型:
【题目】高纯氧化镁具有优良的性能,广泛应用于各种材料。以某厂工业废液(主要成分为MgCl2,含有少量Fe2+、Fe3+、Mn2+等)为原料制备高纯氧化镁的流程如下:
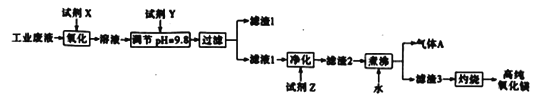
若要求产品尽量不含杂质,而且生产成本较低,请根据下表提供的数据作答。
25℃时,生成氢氧化物沉淀的pH | 原料价格表 | ||||
物质 | 开始沉淀的pH | 沉淀完全的pH | 物质 | 价格/(元·吨-1) | |
Mg(OH)2 | 10.0 | 11.0 | 漂液(含25.5% NaClO) | 450 | |
Mn(OH)2 | 8.3 | 9.8 | 双氧水(含30% H2O2) | 2400 | |
Fe(OH)2 | 7.6 | 9.6 | 烧碱(含98% NaOH) | 2100 | |
Fe(OH)3 | 2.7 | 3.7 | 纯碱(含99.5% Na2CO3) | 600 | |
(1)漂液中NaClO的电子式为_________________;双氧水中H2O2的结构式为___________。
(2)25℃时,Ksp[Mg(OH)2]=_____________。
(3)“氧化”时,所加试剂X的最佳选择为________________,该步反应的离子方程式为____________。
(4)试剂Y的俗称为__________;“调节pH=9.8”的目的为___________________。
(5)“煮沸”时,反应的化学方程式为_______________________。
(6)常温下,取一定量的试剂Z,加水稀释成1.0 L 0.2 mol·L-1的溶液;再向其中缓慢通入0.05 mol气体A充分反应后,所得溶液中各离子浓度由大到小的顺序为________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是( )
A. 钠、钾着火时,不能用干粉灭火器灭火
B. 氧化铝是冶炼金属铝的原料,也是较好的耐火材料
C. 石英是制造光导纤维的原料。也是常用的半导体材料
D. 在汽车尾气系统中装催化转化器,可降低尾气中CO、NOX等的排放量
查看答案和解析>>
科目: 来源: 题型:
【题目】有关用标准盐酸滴定待测氢氧化钠溶液的操作错误的是( )
A.滴定前,应先检验滴定管是否漏液
B.锥形瓶用蒸馏水洗后待用
C.蒸馏水洗后,滴定管应该用所装溶液润洗 1 次
D.滴定时,眼睛应注视锥形瓶中溶液颜色变化
查看答案和解析>>
科目: 来源: 题型:
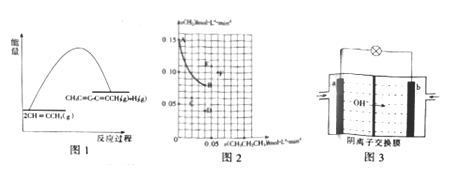
【题目】Glaser反应在研究新型发光材料、超分子化学等方面具有重要价值。一定条件下丙炔(CH≡CCH3)发生Glaser反应制备CH3C≡C—C≡CCH3时,主要副产物为CH3CH2CH3,发生的反应为
I.2CH≡CCH3(g)![]() CH3C≡C—C=CCH3(g)+H2(g) △H1=+60 kJ·mol-1
CH3C≡C—C=CCH3(g)+H2(g) △H1=+60 kJ·mol-1
II.CH≡CCH3(g)+2H2(g)![]() CH3CH2CH3(g) △H2=-179kJ·mol-1
CH3CH2CH3(g) △H2=-179kJ·mol-1
请回答:
(1)反应II的平衡常数表达式K=__________。
(2)为提高CH3C≡C—C=CCH3的产率,可采取的措施为______(任写两条)。
(3)己知:C—H、H —H 的键能分别为414 kJ·mol-1、436 kJ·mol-1,则C—C 的键能为____ kJ·mol-1。
(4)欲提高反应I的速率,向其中加入傕化剂,使该反应分两步进行,且均为吸热反应。下如图为未加催化剂时反应I的能量变化图,请画出加入催化剂后反应过程的能量变化图_____________。
(5)一定温度下,向某恒容密闭容器中充人一定量的CH≡CCH3(g)+2H2(g),发生反应II。一段时间内测定CH3CH2CH3(g)与H2(g)的消耗速率,二者关系如下如图中AB曲线所示。B点时,该反应_________(填“是”或“否”)达到平衡状态,原因为_____________;若此时升高温度,二者速率关系相应的点可能为______________(填字母)。
(6) CH3CH2CH3碱性燃料电池是一种高性能燃料电池,其工作原理如下如图所示。b电极为________(填“正极”或“负极”),该电极的反应式为_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】室温时,向20mL,0.1mol/L的醋酸溶液中不断滴加0.1mol/L的NaOH溶液,溶液的pH变化曲线如图所示,在滴定过程中,下列关于溶液中离子浓度大小关系的描述不正确的是
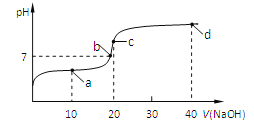
A. a点时:c(CH3COOH) >c(Na+)>c(CH3COO-)>c(H+) >c(OH-)
B. b点时:c(Na+)=c(CH3COO-)
C. c点时:c(OH-)=c(CH3COOH)+ c(H+)
D. d点时:c(Na+) > c(CH3COO-)>c(OH-) >c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】25 ℃时,向20.00 mL浓度均为0.100 0 mol·L-l的三种酸HX、HY、HZ中分别逐滴加入0.100 0 mol·L-l的NaOH溶液,所得溶液的pH随加入NaOH溶液的体积关系如图所示。

下列说法正确的是( )
A. V(NaOH)=0 mL时,三份溶液相比较c(X-)>c(Y-)>c(Z-)
B. 当三份溶液pH均等于7时,反应消耗的n(HX)=n(HY)=n(HZ)
C. 当V(NaOH)=10 mL时,反应后溶液中各离子浓度由大到小的顺序为c(X-)>c(Y-)>c(Z-)>c(Na+),且在HZ溶液中:c(Z-)>c(H+)>c(Na+)>c(OH-)
D. HY与HZ混合溶液中:c(H+)=c(Y-)+c(Z-)+![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与生活密切相关。
I. K2Cr2O7曾用于检测司机是否酒后驾驶:
Cr2O72-(橙色)+CH3CH2OH![]() Cr3+(绿色)+CH3COOH (未配平)
Cr3+(绿色)+CH3COOH (未配平)
(1)基态Cr 原子的价电子轨道表达式为_________________。
(2)CH3COOH分子中所含元素的电负性由大到小的顺序为___________,碳原子的轨道杂化类型为_________,所含σ键与π键的数目之比为______________________。
(3)已知Cr3+等过渡元素水合离子的颜色如下表所示:
离子 | Se3+ | Cr3+ | Fe2+ | Zn2+ |
水合离子的颜色 | 无色 | 绿色 | 浅绿色 | 无色 |
请根据原子结构推测Se3+、Zn2+的水合离子为无色的原因为_______________________。
II. ZnCl2浓溶液常用于除去金属表面的氧化物,例如与FeO反应可得Fe[Zn(OH)Cl2]2溶液。
(4) Fe[Zn(OH)Cl2]2溶液中不存在的微粒间作用力有________(填选项字母);
A.离子键 B.共价键 C.金属键 D.配位键 E.范德华力 F.氢键
溶液中[Zn(OH)Cl2]-的结构式为_____________________。
III.锌是人体必需的微量元素之一,其堆积方式如图1,晶胞结构如图2。

(5)锌的堆积方式为_________,配位数为__________________。
(6)若梓原子的半径为a pm,阿伏加德罗常数的值为NA,则锌晶体的密度为______g/㎝3 (用含a的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com