
科目: 来源: 题型:
【题目】下列关于有机物的说法正确的是
A. 所有的烷烃在光照条件下都能与氯水发生取代反应
B. 1mol 葡萄糖能水解生成2molCH3CH2OH和2molCO2
C. 乙酸与乙酸乙酯的相互转化,不属于同一种有机反应类型
D. 仅用碳酸钠溶液可以鉴别乙酸、苯和乙醇三种无色溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】A是一种重要的食用香料,以A为原料自备阴离子树脂M和新型聚酯材料N等的合成路线如下:

已知:
Ⅰ.![]()
![]() RCHO+RCHO
RCHO+RCHO
Ⅱ.RC(OH)=CH2不稳定,很快转化为RCOCH3
(1)A的结构简式为_________________,反应②的类型为___________________。
(2)B的名称为_____________________,F的分子式为___________________。
(3)写出反应⑥的化学方程式____________________________________。
(4)反应①②③④⑤⑥中原于利用率为100%的有_____________(填字号)。
(5)A的同分异构体有很多种,其中能与金属Na反应生成H2的链状化合物还有__________种,其中核磁共振氢谱峰面积之比为6∶1∶1的同分异构体有_______________________________(写出结构简式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】磷、铁及它们化合物在生产生活及科研中应用广泛。
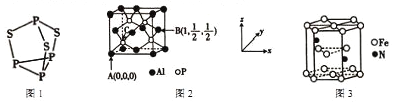
(1)P4S3可用于制造火柴,其分子结构如图1所示。
①P4S3分子中硫原子的杂化轨道类型为 ________________。
②每个P4S3分子中含孤电子对的数目为_________________。
(2)磷化铝熔点为2000℃,它与晶体硅互为等电子体,磷化铝晶胞结构如图2所示。
①磷化铝晶体中磷与铝微粒间的作用力为_______________。
②图中A点和B点的原子坐标参数如图所示, 则C点的原子坐标参数为_____________。
(3)Fe3+、Co3-与N3-、CN-等可形成络合离子。
①C、N、O的第一电离能最大的为____________,其原因是________________________________。
②K3[Fe(CN)6]可用于检验Fe2+, lmol[Fe(CN)6]3-离子中含有σ键的数目为__________________。
③[Co(N3)(NH3)5]SO4中Co的配位数为_____________。
(4)化合物FeF3熔点高于1000℃,而Fe(CO)5的熔点却低于0℃, FeF3熔点远高于Fe(CO)5的可能原因是__________________________________________________。
(5)某种磁性氮化铁晶体的结构如图 3所示,该化合物的化学式为_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】ClO2是一种优良的消毒剂,浓度过高时易发生分解,常将其制备成NaClO2固体以便运输和贮存。过氧化氢法制备NaClO2固体的实验装置如图1所示。
已知:2NaClO3+H2O2+H2SO4===2ClO2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH===2NaClO2+O2↑+2H2O
ClO2熔点-59 ℃、沸点11 ℃;H2O2沸点150 ℃
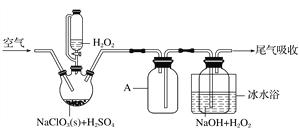
图1
请回答:
(1)仪器A的作用是___________________________________________;冰水浴冷却的目的是____________________________________(写出两种)。
(2)空气流速过快或过慢,均降低NaClO2产率,试解释其原因______________________________________。
(3)Cl-存在时会催化ClO2生成。反应开始时在三颈烧瓶中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气。该过程可能经两步反应完成,将其补充完整:
①________________________________________________________________________
(用离子方程式表示),②H2O2+Cl2===2Cl-+O2+2H+。
(4)H2O2浓度对反应速率有影响。通过图2所示装置将少量30%H2O2溶液浓缩至40%,B处应增加一个设备。该设备的作用是________,馏出物是________。
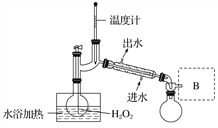
图2
(5)抽滤法分离NaClO2过程中,下列操作不正确的是________。
A.为防止滤纸被腐蚀,用玻璃纤维代替滤纸进行抽滤
B.先转移溶液至漏斗,待溶液快流尽时再转移沉淀
C.洗涤沉淀时,应使洗涤剂快速通过沉淀
D.抽滤完毕,断开水泵与吸滤瓶间的橡皮管后,关闭水龙头
查看答案和解析>>
科目: 来源: 题型:
【题目】三氧化二镍是一种重要的电子元件材料、蓄电池材料。工业上利用含镍废料(以镍、铁、钙、镁合金为主)制取草酸镍(NiC2O4·2H2O),再高温煅烧草酸镍制取三氧化二镍。已知草酸的钙、镁、镍盐均难溶于水。根据下列工艺流程示意图回答问题。
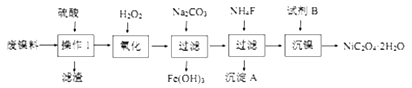
(1)操作1的名称为____________________________________。
(2)沉淀A为_________________________(用电子式表示)。
(3)试剂B的名称为_______________,沉镍后,滤液中C2O42-的浓度为0.01mol/L,则残留在滤液中的 c(Ni2+)=_______________(已知Ksp[NiC2O4]= 4×10-10)。
(4)NiC2O4·2H2O 高温煅烧制取三氧化二镍的热重曲线如右图所示:

①T3温度后,草酸镍全部转化为三氧化二镍,则a为_______________(保留一位小数)。
②T2温度发生反应的化学方程式为__________________________。
(5)高温煅烧草酸镍制取三氧化二镍时会产生CO、CO2、水蒸气等混合气体。某同学设计如下实验流程进行检验。
混合气体![]() 现象
现象![]() 澄清石灰水变浑浊
澄清石灰水变浑浊
①试剂1的化学式为_____________________。
②碱石灰的作用是________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氢气是一种新型的绿色能源,又是一种重要的化工原料。以生物材质(以C 计)与水蒸气反应制取H2是一种低耗能,高效率的制H2方法。该方法由气化炉制造H2和燃烧炉再生CaO两步构成。气化炉中涉及到的反应为:
Ⅰ C(s)+H2O(g)![]() CO(g)+H2(g) K1;
CO(g)+H2(g) K1;
Ⅱ CO(g)+H2O(g)![]() CO2(g)+H2(g) K2;
CO2(g)+H2(g) K2;
Ⅲ CaO(s)+CO2(g)![]() CaCO3(s) K3;
CaCO3(s) K3;
燃烧炉中涉及到的反应为:
Ⅳ C(s)+O2(g)=CO2
Ⅴ CaCO3(s)=CaO(s)+CO2(g)
(1)该工艺制H2总反应可表示为C(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g),其反应的平衡常数K=_________(用K1、K2、K3的代数式表示)。在2L的密闭容器中加入一定量的C(s)、H2O(g)和CaO(s)。下列能说明反应达到平衡的是_______________。
CaCO3(s)+2H2(g),其反应的平衡常数K=_________(用K1、K2、K3的代数式表示)。在2L的密闭容器中加入一定量的C(s)、H2O(g)和CaO(s)。下列能说明反应达到平衡的是_______________。
A.容器内压强不再变化 B.H2与H2O(g)的物质的量之比不再交化
C.混合气体的密度不再变化 D.形成amolH-H键的同时断裂 2amolH-O键
(2)对于反应Ⅰ,不同温度和压强对H2产率影响如下表。
压强 温度 | p1/Mpa | p2/Mpa |
500℃ | 45.6% | 51.3% |
700℃ | 67.8% | 71.6% |
下列图像正确的是_________。
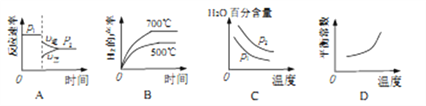
(3)已知反应Ⅱ的△H=-41.1kJ/mol, C=O、O-H、H-H的键能分别为803KJ/mol,464 kJ/mol、436kJ/mol,则 CO中碳氧键的键能为_________ kJ/mol。
(4)对于反应Ⅲ,若平衡时再充入CO2,使其浓度增大到原来的2倍,则平衡移动方向为_________;当重新平衡后,CO2浓度_________(填“变大”“变小”“不变”)。
(5)氢镍电池具有无记忆、无污染,免维护等特点,被称为绿色电池。该电池的总反应为:H+NiOOH![]() M+Ni(OH)2,其中M为储氢合金材料,则充电过程中的阴极反应式为_______________。
M+Ni(OH)2,其中M为储氢合金材料,则充电过程中的阴极反应式为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com