
科目: 来源: 题型:
【题目】某溶液中有Fe3+、Mg2+、Fe2+和Al3+四种阳离子,若向其中加入过量的氢氧化钠溶液,搅拌后,再加入过量的盐酸,溶液中大量减少的阳离子是( )
A.Fe3+ B.Mg2+ C.Fe2+ D.Al3+
查看答案和解析>>
科目: 来源: 题型:
【题目】研究CO2、CO是处理方法对环境保护用重要意义。
(1)已知:①CO2(g)+H2(g)![]() CO(g)+H2O(g) △H=+41kJ·mol-1
CO(g)+H2O(g) △H=+41kJ·mol-1
②C(g)+2H2(g)![]() CH4(g) △H=-73kJ·mol-1
CH4(g) △H=-73kJ·mol-1
③2CO(g)![]() C(g)+CO2(g) △H=-171kJ·mol-1
C(g)+CO2(g) △H=-171kJ·mol-1
则CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) △H=__________。
CH4(g)+2H2O(g) △H=__________。
(2)CO2与H2反应可合成甲醇:CO2(g)+3H2(g)![]() CH4(g)+H2O(g)
CH4(g)+H2O(g)
某温度下,将1molCO2和3molH2充入探究不变的2L密闭容器中,发生上述反应。测得不同时刻的反应前后压强关系如下:
时间(h) | 1 | 2 | 3 | 4 | 5 | 6 |
P后/p前 | 0.90 | 0.85 | 0.82 | 0.81 | 0.80 | 0.80 |
①用CO2表示第1小时反应的平均速率v(CO2)=_______mol·L-1·h-1。
②该温度下的H2平衡转化率为______________。
(3)CO2与NH3反应可合成尿素:CO2(g)+2NH3(g)![]() CO(NH2)2(s)+H2O(g)
CO(NH2)2(s)+H2O(g)
在T1℃时,将1molCO2和2molNH3置于1L密闭容器中,发生上述反应,在t时刻,测得容器中CO2转化率约为73%。保护其他初始实验条件不变,分别在温度为T2℃、T3℃、T4℃、T5℃时,重复上述实验,经过相同时间测得CO2转化率并绘制变化曲线如图所示:
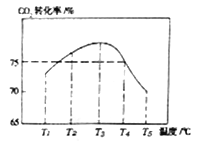
①该反应的△H______0(填“>”或“<”)
②T4℃时该反应的平衡常数K=___________。
③在T1℃~T3℃之间,CO2转化率逐渐增大,其原因是____________________。
(4)工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如图所示
img src="http://thumb.1010pic.com/questionBank/Upload/2018/01/02/09/ce4caee6/SYS201801020935301407189654_ST/SYS201801020935301407189654_ST.003.png" width="212" height="154" style="-aw-left-pos:0pt; -aw-rel-hpos:column; -aw-rel-vpos:paragraph; -aw-top-pos:0pt; -aw-wrap-type:inline" />
①阳极区产生CO2的原因是______________(用离子方程式表示)。
②利用平衡移动原理,简述CO32-在阴极区再生的原因_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】电镀废液的综合利用有利于减少重金属对水体的污染。某实验小组用以下流程模拟利用一定量工业电镀废液(强酸性,含Cr2O72-、杂质Cu2+等)制备水溶性皮革鞣剂Cr(OH)SO4。回答下列问题:
(已知lg2=0.3,Ksp[ Cr(OH)3]=6.4×10-31, Ksp[ Cu(OH)2]=2×10-20 )
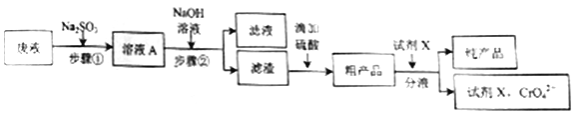
(1)加Na2SO3前先将废液调为弱酸性溶液的原因是__________________,写出废液中加Na2SO3时发生反应的离子方程式_____________。
(2)步骤①须保持温度在30~50℃,可采用的措施是___________________。
(3)步骤②的操作名称是___________。
(4)若在步骤②中,使Cr3+完全沉淀,则溶液的pH范围为______________,
[已知溶液中c(Cu2+)=2×10-4mol·L-1,完全沉淀时c(Cr3+)<10-5 mol·L-1]
(5)粗产品中含有微量CrO42-,工业选择的试剂X应满足的条件是__________。
A.与水互不相溶 B.CrO42-在X中溶解度小
C.Cr(OH)SO4在X中溶解度大 D.Cr(OH)SO4与X不反应
(6)若工业电镀废液含0.1mol Cr2O72-,最终制得产品31.35g,则产率为__________。
(7)酸性条件下,蔗糖还原Na2Cr2O7也可制备Cr(OH)SO4:
Na2Cr2O7+NaHSO4+C12H22O11→Cr(OH)SO4+Na2SO4+H2O+CO2(未配平)
①反应中每生成1molCr(OH)SO4,理论上需要C12H22O11_________mol
②将生成液降温至17℃以下,静置,过滤,在80℃时蒸发滤液,得到标准的工业产品,该产品中混有的主要杂质是________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】科学家刚刚发现了某种元素的原子,其质量是a g,12C的原子质量是b g,NA是阿伏加德罗常数的值,下列说法不正确的是( )
A. 该原子的摩尔质量是a NA B. W g该原子的物质的量一定是![]() mol
mol
C. W g该原子中含有![]() 个该原子 D. 由已知信息可得:NA=
个该原子 D. 由已知信息可得:NA=![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关说法正确的是( )
A. 22.4LO2中一定含有NA个氧分子
B. 1mol/LNaCl的溶液中一定含有2NA个离子
C. 2.3g金属钠在足量氧气中充分燃烧,转移0.1NA个电子
D. 4g氦气含有0.5NA个氦分子
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大,X和W同主族且W的单质是重要的半导体材料,Y原子的最外层电子数是其内层电子数的3倍,Z2+与Y2-核外电子排布相同。下列说法正确的是
A. X的氢化物中仅含有极性键
B. X与Y形成的三原子分子的电子式是![]()
C. 原子半径Z>Y,离子半径Z2+< Y2-
D. X、Y的非金属性强弱可用其氧化物的水化物的酸性强弱来推断
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验设计可行的是( )
A. 将O2和H2的混合气体通过灼热的氧化铜,以除去其中的H2
B. 加盐酸后过滤,除去混在铜粉中的少量镁粉和铝粉
C. 用萃取的方法分离汽油和煤油
D. 用溶解、过滤的方法分离KNO3和NaCl固体混合物
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应中,HCl被氧化的是( )
A. NaOH+HCl===NaCl+H2O B. Fe+2HCl===FeCl2+H2↑
C. CuO+2HCl===CuCl2+H2O D. MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com