
科目: 来源: 题型:
【题目】铃兰醛具有甜润的香味,常用作肥料、洗涤剂和化妆品的香料。合成铃兰醛的路线如图所示(部分试剂和条件未注明):
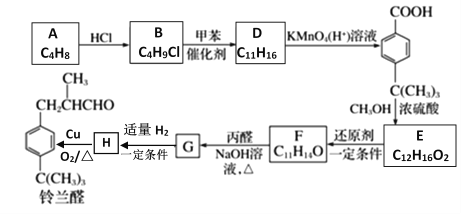
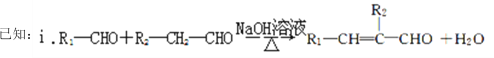

请回答下列问题:
(1)A的系统命名为:__________________;B→D的反应类型:_______________
(2)A→B的化学方程式是___________________________________________;
(3)H→铃兰醛的化学方程式是___________________________________________;
(4)下列有关G的叙述中,不正确的是______(填序号)。
A.G分子中有6种不同化学环境的氢原子
B.G能发生消去反应、氧化反应和还原反应
C.1molG最多能与5molH2发生加成反应
D.G能使溴水褪色
(5)H的同分异构体有多种,试写出满足以下条件的一种结构简式:__________。
①遇FeCl3溶液呈紫色,②核磁共振氢谱中有四种类型氢原子的吸收峰。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图①到⑩分别代表反应中的一种物质,且它们均为化学中的常见物质。
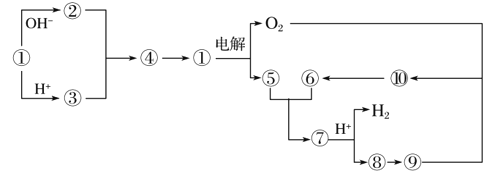
(1)①的化学式为________,⑤和⑥反应的化学方程式为________________________________。
(2)实验室由⑧制取⑨的离子方程式为________________________________,⑨转变为⑩的化学方程式为________________________________________。
由⑨转变为⑩的反应现象为__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】物质X是某新型净水剂的中间体,它可以看成由氯化铝(在180 ℃升华)和一种盐A按物质的量之比1∶2组成。在密闭容器中加热8.75 g X使之完全分解,冷却后可得到3.2 g固体氧化物B、0.448 L无色气体D(体积已折算为标准状况)、4.27 g混合晶体E。B溶于稀盐酸后,滴加KSCN溶液,混合液变血红色。D气体能使品红溶液褪色。请回答下列问题:
(1)X的化学式为_________。
(2)将A固体隔绝空气充分灼烧,使其分解,生成等物质的量的B、D和另一种化合物,则A分解的化学方程式为_____________________________________________________。
(3)将E混合晶体溶于水配成溶液,逐滴加入过量稀NaOH溶液,该过程的总反应的离子方程式为________________________________。
E混合晶体中某种物质在一定条件下能和KI固体反应,写出该方程式:___________________。
(4)高温下,若在密闭容器中长时间煅烧X,产物中还有另外一种气体,其分子式是________。请设计实验方案验证之____________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】从古至今,铁及其化合物在人类生产生活中的作用发生了巨大变化。
(1)古代中国四大发明之一的司南是由天然磁石制成的,其主要成分是______(填字母序号)。
a. Fe b. FeO c. Fe3O4 d. Fe2O3
(2) 现代利用铁的氧化物循环裂解水制氢气的过程如下图所示。 整个过程与温度密切相关, 当温度低于 570℃时,反应Fe3O4(s)+4 CO(g)![]() 3Fe(s)+4 CO2(g),阻碍循环反应的进行。
3Fe(s)+4 CO2(g),阻碍循环反应的进行。
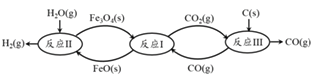
① 已知:Fe3O4(s) + CO(g) ![]() 3FeO(s) +CO2(g) ΔH1 = +19.3 kJ·mol-1
3FeO(s) +CO2(g) ΔH1 = +19.3 kJ·mol-1
3FeO(s) + H2O(g)![]() Fe3O4(s) + H2(g) ΔH2 =-57.2 kJ·mol-1
Fe3O4(s) + H2(g) ΔH2 =-57.2 kJ·mol-1
C(s)+CO2![]() 2CO(g) ΔH3 =+172.4 kJ·mol-1 。
2CO(g) ΔH3 =+172.4 kJ·mol-1 。
铁氧化物循环裂解水制氢气总反应的热化学方程式是_________。
② 下图表示其他条件一定时, Fe3O4(s)和 CO(g)反应达平衡时 CO(g)的体积百分含量随温度的变化关系。
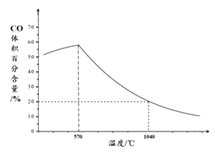
i. 当温度低于570℃时,温度降低CO的转化率____(填“增大”、“减小”或“不变”),理由是______。
ii. 当温度高于570℃时,随温度升高,反应 Fe3O4(s) + CO(g) ![]() 3FeO(s) + CO2(g)平衡常数的变化趋势是________;(填“增大”、“减小”或“不变”)1040℃时,该反应的化学平衡常数的数值是________。
3FeO(s) + CO2(g)平衡常数的变化趋势是________;(填“增大”、“减小”或“不变”)1040℃时,该反应的化学平衡常数的数值是________。
(3)① 古老而神奇的蓝色染料普鲁士蓝的合成方法如下:

复分解反应 ii 的离子方程式是_______________。
② 如今基于普鲁士蓝合成原理可检测食品中 CN-,方案如下:
![]()
若试纸变蓝则证明食品中含有 CN-,请解释检测时试纸变蓝的原因_________。
(4)已知25℃时,Kap[Fe(OH)3]=4.0×10-38,此温度下若在实验室中配置100mL 5mol/LFeCl3溶液,为使配置过程中不出现浑浊现象,则至少需要加入2mol/L的盐酸_________mL(忽略加入盐酸体积)。
查看答案和解析>>
科目: 来源: 题型:
【题目】将少量氯水加入盛有KBr溶液的试管中,再加入适量的汽油,然后振荡,静置,产生的现象是( )
A. 溶液呈橙色
B. 溶液呈无色
C. 上层液体呈橙色,下层液体几乎无色
D. 上层液体呈紫红色,下层液体几乎无色
查看答案和解析>>
科目: 来源: 题型:
【题目】只用一种试剂可区别Na2SO4 、MgCl2 、FeCl2 、Al2(SO4)3 、(NH4)2SO4 五种溶液,这种试剂是 ( )
A. Ba(OH)2 B. H2SO4 C. NaOH D. AgNO3
查看答案和解析>>
科目: 来源: 题型:
【题目】根据表提供的数据,下列判断正确的是
弱酸化学式 | CH3COOH | HClO | H2CO3 |
电离平衡常数 | 1.8×10-6 | 3.0×10-8 | Ka1=4.3×10-7 Ka2=5.6×l0-11 |
A. 等物质的量的Na2CO3和CH3COOH两种溶液混合,一定有:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(CH3COO-)
B. 常温下,已知酸H2A存在如下平衡:H2A![]() H++HA-;HA-
H++HA-;HA-![]() H++A2-(Ka1=5.9×10-2,Ka2=6.4×10-6),则NaHA溶液中水的电离程度一定大于纯水中水的电离程度
H++A2-(Ka1=5.9×10-2,Ka2=6.4×10-6),则NaHA溶液中水的电离程度一定大于纯水中水的电离程度
C. 相同浓度的CH3COONa和NaClO混合溶液中各离子浓度大小关系是:C(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
D. 常温下,在0.1mol/LCH3COOH溶液中滴加0.1mol/LNaOH的溶液发生反应,当c(CH3COOH):c(CH3COO-)=5:9时,此时溶液pH=5
查看答案和解析>>
科目: 来源: 题型:
【题目】向一定量AgNO3和Cu(NO3)2的混合溶液中加入Zn粉,所得溶液质量与加入Zn粉的质量关系如图所示,下列说法正确的是( )
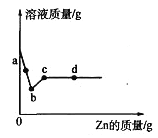
A. a点溶液中的溶质有2种
B. c点溶液中溶质为Zn(NO3)2
C. 取d点的固体,加入稀盐酸,无气泡产生
D. 若取b~c段溶液,滴加稀盐酸,有白色沉淀产生
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com